Până în prezent, nu există un singur punct de vedere în acest sens. care ioni și în ce măsură sunt implicați în transferul curent în timpul producției electrolitice de aluminiu. Cei mai mulți oameni de știință sovietici dețin teoria lui PP Fedoțiev, dezvoltată de el în 1923-193. Ulterior, lucrările oamenilor de știință sovietici (VP Mashovets, GA Abramov și alții) l-au clarificat. Conform acestei teorii, criolitul topit. conductiv, disociază în ioni:
O astfel de disociere caracter criolit bine sprijinit zăbrele sale structură cristalină (Fig. A) și în care axele se află octaedru Nove cu ion de aluminiu, în centrul și șase ioni de fluor la colțuri. Și, din moment ce se presupune că lichidul în apropierea punctului de topire nu este foarte diferit în structura din corpul rigid, apoi pentru topirea criolit în acesta trebuie să fie formate „fragmente“ de grilaj sale, adică a ionilor de 03 iunie ALH .. -.
Fig. Grile cristaline de criolit (a) și corund (b)
Alumina, dizolvată în criolitul topit, se disociază în ioni de aluminiu și ioni care conțin oxigen, iar PP Fedotov credea că cel mai probabil este schema
Unii cercetători nu împărtășesc opinia PP Fedotiev cu privire la natura disocierii aluminei în electrolit. Astfel, VP Mashovets a presupus că oxigenul este în electrolit sub formă de ioni de AlO2. VA Pazukhin a crezut că acestea au fost ioni de AOF 4 5. Există împreună cu ioni de O2. Potrivit lui VM Guskov, AI Belyaev și alții, alumina din topitura de criolit-argilă-pământ împreună cu alți ioni formează ioni de O2 și Al3 +.
Se pare că mecanismul procesului de electroliză ar trebui prezentat în următoarea formă. Criolitul în timpul topirii în apropierea punctului de topire va consta din ioni Na + și AlF 3 6 - de atunci
legăturile ionice din rețeaua cristalină dintre sodiu și fluor sunt mai slabe decât între aluminiu și fluor. Dar acest lucru nu exclude posibilitatea unei distrugeri ulterioare a rețelei cristaline de ionii Al 3+ și F.
Deoarece rețeaua cristalină a aluminei este format din ioni Al 3+ și O 2- (Fig. B), apoi alumina dizolvare în criolit topit, se descompune acestor ioni. Dar este foarte probabil ca ionii de oxigen având o dimensiune mică și o sarcină relativ mare, în legătură cu alți ioni, pentru a forma unor ioni de oxigen complexe (AlO2 - sau chiar AlOF 4 5 -).
Astfel, electrolitul topit al unei băi de aluminiu pare să fie alcătuit din ioni Al 3+. Na + F- și O 2-. care, în mișcare continuă și interacțiune, pot forma ioni complexi AlF 3 6 -. Al02 -. Poate formarea altor complexe. Toate aceste ioni participă la transferul actual, deși cota lor în acest transfer nu este aceeași și este determinată de concentrarea și mobilitatea lor.
Descărcarea electrozilor nu va include toți ionii implicați în transferul curent, ci numai aceia care au valorile corespunzătoare ale potențialelor electrodului. La catodul de la electrolitul topiturilor de criolit-alumină, ionul de Al 3+ va fi descărcat în prima etapă. iar la anod ionul O 2-.
Oxigenul eliberat la anod interacționează cu unde anodul generează și formează un amestec de gaze CO și CO2. Aceste gaze, eliberate la suprafața anodului, sunt îndepărtate în atmosferă. În același timp, CO arde până la CO2. formând flăcări peste crustă.
Astfel, procesul de electroliză reduce producția de aluminiu și consumul de alumină.
Efectul anodic al electrolizei topiturilor de alumină
1%, pentru o celulă electrolitică care funcționează în mod normal, efectul de anod se produce, apare în exterior, după cum urmează: tensiune de celule (de obicei egal 4,1- 4,5) începe să crească cu câteva zecimi de lobi volt, apoi crește brusc la 20-40 și un bec se aprinde intermitent pe voltmetrul de comandă. Pe suprafața anodului, în contact cu electrolitul, apar arcuri, însoțite de un zgomot caracteristic. Electrolitul se încălzește rapid, evaporarea se intensifică. Dar suficient pentru a se dizolva. electrolit o noua portiune de alumina, pe masura ce tensiunea pe baie scade, efectul de anod dispare si se restabileste cursul normal de electroliza.
În producția electrolitică a aluminiului, efectul anodic joacă un rol important. Pe de o parte, facilitează serviciul, Anna, semnalând timpul de încărcare a acesteia o dată pe porțiunea de alumină și oferă o indicație a ceea ce este normal sau anormal de baie de lucru. Dacă baia funcționează corespunzător, efectul anod este caracterizat printr-o creștere bruscă de putere se produce și la intervale regulate, corespunzătoare porțiunilor încărcate într-o baie de alumină și forță de muncă. În cazul în care efectul de anod apare foarte târziu sau prea devreme și a tensiunii celulei în timpul efectului anodic crește ușor sau pulsatorie ( „intermitent“ sau flash „plictisitoare“), baie funcționează anormal și are nevoie de o supraveghere foarte atentă și de întreținere.
Pe de altă parte, apariția efectelor anodice afectează în mod negativ electroliza, provocând o creștere a consumului de energie electrică a sărurilor de fluor și anodelor și, de asemenea, complică activitatea surselor de curent electric direct.
Prin urmare, plantele de aluminiu încearcă să aibă un număr minim de efecte anodice, permițând apariția lor nu mai mult de o dată pe zi, timp de 2-4 minute. Brigada avansată conduce electroliza. permițând efectul anodic o dată la 3-5 zile.
Efectul anod atrage atenția multor cercetători și natura ei are multe puncte de vedere diferite. Un studiu de capital al naturii efectului anodic a fost realizat la Institutul de Metale și aur neferoase din Moscova, numit după Yu. MI Kalinina sub conducerea Corr. AI Belyaeva cu participarea lui BA Kuzmin.
Rezultatele cercetării au dus la concluzia că efectul de anod inerent nu numai la electroliza crio-lito-alumină topește cu anozi de carbon (așa cum este sugerat de mulți cercetători străini), dar, de asemenea, caracteristica procesului electrolitic în săruri topite cu orice anozi. Efectul anod se produce, în cazul în care densitatea de curent la anod, devine mai mare critic.
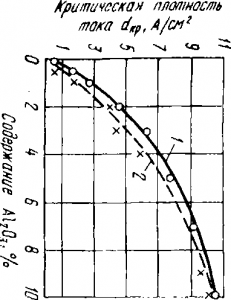
Fig. 2. Schimbarea densității critice de curent în funcție de conținutul de alumină în topiturile de criolit-alumină:
1 - conform datelor AI Belyaev și BA Kuzmin; 2 - în conformitate cu Karp Chevov, Dolgov și Konchinsky
Mărimea densității critice a curentului și, în consecință, apariția efectului anodic depinde de natura sării topite, de cantitatea de oxizi dizolvate în sarea topită, de materialul anodic și de temperatura sării topite. De exemplu, densitatea critică de curent pentru sărurile de clorură topită este mai mare decât pentru sărurile de fluor. Prezența oxizilor dizolvați în sarea topită are un efect deosebit de puternic asupra densității critice de curent.
În Fig. 2 prezintă dependența densității critice de curent în topiturile de criolit-alumină pe conținutul de Al2O3. După cum rezultă din această dependență, cu o creștere a conținutului de Al2O3 în topitura criolit-alumină, crește densitatea critică a curentului și, în consecință, probabilitatea efectului anodic este scăzută. Deoarece băile de aluminiu funcționează la o densitate a curentului anodic de 0,7 până la 1,2 A / cm2, conform graficului se poate concluziona că efectul anodic ar trebui să aibă loc atunci când conținutul de alumină din electrolit scade
Pe baza rezultatelor cercetărilor efectuate de oamenii de știință sovietici, este posibil să se prezinte mecanismul efectului anodic după cum urmează: cu o cantitate semnificativă de alumină în
Electrolitul topește bine suprafața anodului și, prin urmare, înmuie bulele de gaz rezultate. Pe măsură ce concentrația de alumină dizolvată în electrolit scade, acesta din urmă începe să udeze electrodul mai rău și mai rău și când valoarea unghiului de contact al umezelii depășește 90 °, acesta încetează să ude electrodul. Drept urmare, gazul începe să rămână pe suprafața anodului, este acoperit rapid cu un film de gaz, rezistența la interfața anodic-electrolitică crește brusc. Numai în anumite locuri, unde filmul de gaz este întrerupt temporar, apar arcuri electrice cu durată scurtă. Când o nouă porțiune de alumină este introdusă în electrolit, electrolitul începe să ude din nou anodul, îndepărtează rapid pelicula de gaz de pe suprafața sa și tensiunea pe baie scade.
Procese adverse la catod și în electrolit
În procesul electrolitic pentru producerea aluminiului, în plus față de procesele principale discutate mai sus, apar unele procese laterale care pot duce la pierderea de metale, consumul de energie crescut, deteriorarea calității metalului, modificări ale compoziției electrolitului etc. cele mai importante dintre ele: dizolvarea aluminiului, formarea carburii de aluminiu, impregnarea căptușelii băii cu electrolitul.
Dizolvarea aluminiului în electrolit
Aluminiu metalic se dizolvă ușor în electrolitul topit (de ordinul a 0,1%). Cu toate acestea, se răspândesc prin electrolit, aluminiul este oxidat pe suprafața acestora cu oxigenul atmosferic, dar, de asemenea, reacționează cu gazul anod pentru a forma Al2 O3 și determinând astfel dizolvarea noi porțiuni ale metalului din electrolit. Solubilitatea aluminiului în electrolit și, în consecință, oxidarea metalului crește puternic cu o scădere a distanței interpolare și cu o creștere a temperaturii. În acest sens, ele se străduiesc să conducă procesul la cea mai mică temperatură posibilă, dar fără a reduce distanța excesivă mezhpolosnoe.
Formarea carburii de aluminiu
În cazul supraîncălzirii băii, aluminiu începe să reacționeze cu carbonul care intră în electrolit, formând carbură de aluminiu:
Condițiile favorabile pentru formarea carburii sunt create dacă, sub stratul de aluminiu, există un cărbune
fundul sau peretele băii (datorită topirii părții laterale a patului). Apoi, direct pe suprafața de carbon, ionii de aluminiu sunt evacuați, iar atomii de aluminiu, interacționând cu carbonul, formează carbură. Carbura de aluminiu este refractară, are o densitate ridicată și conductivitate electrică scăzută; se formează pe fundul băii sub un strat de aluminiu, precum și în masa electrolitului, creând rezistență suplimentară. Aluminiu poate reacționa cu carbon, penetrează porii și fisurile garniturii de carbon, formând astfel cristale de carbură de culoare galben strălucitoare.
Schimbarea compoziției electrolitului
Electrolitul din baie își schimbă compoziția în timp, nu întotdeauna aceeași. Observațiile arată că în primele luni de funcționare a unei băi noi, electrolitul își pierde o cantitate semnificativă de fluorură de sodiu și devine acid. În băile vechi care lucrează mai mult de un an, se observă imaginea opusă: electrolitul pierde fluorura de aluminiu și devine alcalin.
Studiul proceselor de umectare a sărurilor fluorurate ale materialelor carbonice, realizat la Institutul de Metale și aur neferoase, MI Kalinina AI Belyaev cu colegii. a arătat că fluorura de sodiu umezește materialele carbonice mult mai bine decât criolitul sau fluorura de aluminiu.
Prin urmare, fluorura de sodiu. care pot apărea în electrolit ca urmare a unei anumite disociere a criolitului, vor fi absorbite în mod predominant în porii catodurilor și blocurilor de carbon din baia nou lansată, încălcând astfel raportul criolit al electrolitului. Studiile privind blocurile inferioare ale băii electrolitice vechi, eșuate confirmă această concluzie. Densitatea blocurilor în timpul funcționării băii crește până când baia este oprită o dată și jumătate, iar produsul absorbit de blocuri conține 70-75% NaF; 5-7% AlF3; până la 20% din AI2O3. precum și o anumită cantitate de Al4C3 și sodiu metalic.
Absorbția selectivă de către căptușeala de carbon a fluorurii de sodiu, care este semnificativă în primele luni ale băii datorită umplerii porilor, scade treptat și după câteva luni se oprește complet.
Pierderea fluorurii de aluminiu din electrolit este posibilă din cauza unei anumite volatilizări a acestei substanțe. în special în timpul efectelor anodice, deoarece elasticitatea vaporilor AlF3 la temperatura procesului este de aproximativ 1 kPa.
Împreună cu evaporarea fluorurii de aluminiu, criolitul interacționează cu impuritățile (SiO2, Na2O, H2O), care intră în baie împreună cu alumină și săruri de fluor. Na2O, care rămâne în alumină din cauza spălării insuficiente a hidratului, descompune criolitul conform următoarei reacții:
SiO2 care intră în baie ca amestec de alumină și criolit se descompune parțial, contaminează aluminiu cu siliciu și interacționează parțial cu criolitul conform reacției
formând tetrofluorură de siliciu volatil și distrugând complexele de ioni de fluor și aluminiu (AlF3-6 - etc.).
La întreținerea normală a unei băi se introduce numai produse preliminare bine încălzite. Prin urmare, vaporii de apă pot pătrunde în electrolitul topit numai dacă în alumină există o cantitate de hidrați de alumină. În aceste cazuri, reacția
Toate aceste reacții conduc la un exces de fluorură de sodiu în electrolit.
Trimiteți-le prietenilor: