(*) Această clasificare este condiționată, deoarece aceiași hormoni pot îndeplini funcții diferite
119. Structura, sinteza și metabolismul iodotironinelor. Influența asupra schimbului de substanțe. Schimbarea metabolismului în hipo și hipertiroidism. Cauzele și manifestarea goiterului endemic.
Biosinteza iodotironinelor. Iodothyronine sintetizat ca parte a proteinei tiroglobulina de (Tg) în foliculi care sunt unitate morfologică și funcțională a glandei tiroide.
Tiroglobulină este sintetizat pe ribozomi sub forma ER pretireoglobulina dur, apoi transferat la ER rezervor, în cazul în care are loc formarea structurii secundare și terțiare, inclusiv procesele de glicozilare. De la rezervoarele Tiroglobulina ER intră în aparatul Golgi, incluse în granule secretoare și este secretată în coloidul extracelular, unde iodurarea resturilor tirozil și formarea iodotironine. Iodizarea tiroglobulinei și formarea de iodotironine se efectuează în mai multe etape
Transportul iodului în celulele glandei tiroide. Iodul sub formă de compuși organici și anorganici intră în tractul digestiv cu alimente și apă potabilă. Cerința zilnică pentru iod este de 150-200 μg. 25-30% din această cantitate de ioduri este captată de glanda tiroidă. Transportul iodului în celulele glandei tiroide este un proces dependent de energie și are loc cu participarea unei proteine speciale de transport împotriva gradientului electrochimic (raportul dintre concentrațiile de I în fier și concentrația de I în ser este de obicei 25: 1). Activitatea acestei proteine de transfer de iodură este conjugată cu Na +, K + -ATPază.
Oxidarea iodului. Oxidarea compusului I - in I + are loc cu participarea tireperoxidazei care conține gem și H2O2 ca agent de oxidare. Iodarea tirozinei. Iodul oxidat interacționează cu resturile de tirozină din molecula de tiroglobulină. Această reacție este, de asemenea, catalizată de thyroperoxidase.
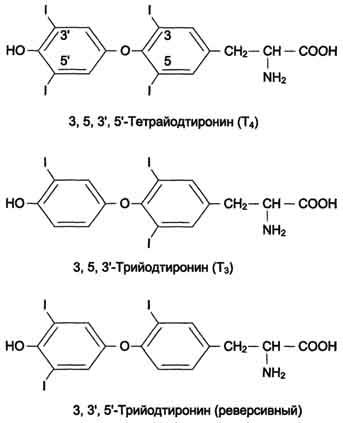
Formarea iodotironinelor. Sub acțiunea tioreperoxidazei, iodul oxidat reacționează cu resturile de tirozină pentru a forma monoiodotroizine (MIT) și diiodotirozine (DIT). Două molecule de DIT condensează pentru a forma iodotironina T4. și MIT și DIT - cu formarea de iodothyronină T3. Iodireglobulina este transportată din coloid în celula foliculară prin endocitoză și hidrolizată de enzimele lizozomale cu eliberarea T3 și T4. În condiții normale, glanda tiroidă secretă 80-100 pg de T4 și 5 pg de T3 pe zi. Un alt 22-25 pg de T3 este format ca urmare a deiodinării T4 în țesuturile periferice de-a lungul atomului de carbon 5'-a.
Transportul și metabolismul iodotironinelor. De la jumătate la două treimi, T3 și T4 se află în corpul din afara glandei tiroide. Cele mai multe dintre ele circulă sub forma de sange legat un complex cu proteine: globulinei de legare a tiroxinei (TBG) și tiroxina legare prealbumin (LSPA). TSG servește drept principala proteină de transport a iodotironinelor, precum și forma depunerii lor. El are o afinitate mai mare pentru T3 și T4 și în condiții normale se leagă aproape întreaga cantitate a acestor hormoni. Doar 0,03% din T4 și 0,3% din T3 sunt în sânge în formă liberă. T1 / 2 T4 în plasmă este de 4-5 ori mai mare decât T3. Pentru T4, această perioadă este de aproximativ 7 zile, iar pentru T3 - 1-1,5 zile. Activitatea biologică a iodotironinelor se datorează fracțiunii nelegate. T3 - principala formă biologic activă de iodotironine; afinitatea sa pentru receptorul celular țintă este de 10 ori mai mare decât cea a T4. În țesuturile periferice, așa-numita „inversare“ formă T3 parte, ca urmare a deiodination T4 pe atomul de carbon al cincilea. care este aproape complet lipsită de activitate biologică. Alte modalități de metabolizare a iodotironinelor includ deiodinația completă, deaminarea sau decarboxilarea. Produsele iodurati de iodotironine catabolism Xia conjugate în ficat cu acizi sulfurici sau glucuronic sunt secretate cu bilă, sunt absorbite în intestin din nou deiodurat în rinichi și excretat în urină.
Mecanismul de acțiune și funcțiile biologice ale iodotironinelor. Celulele țintă ale iodotironinelor au 2 tipuri de receptori pentru acești hormoni. Efecte principale iodotironine - rezultatul interacțiunilor lor foarte specifice cu receptori care în combinație cu hormoni locuiesc în nucleu și interacționează cu secvențe specifice de ADN care participă la reglarea expresiei genice. Alți receptori sunt localizați în membrana plasmatică a celulelor, dar acestea nu sunt aceleași proteine ca și în nucleu. Ei au o afinitate mai scăzută pentru iodotironine și, probabil, asigură legarea hormonilor pentru a le menține în imediata apropiere a celulei. Cu concentrația fiziologică a iodotironinelor, efectul lor se manifestă prin accelerarea sintezei proteinelor, stimularea proceselor de creștere și diferențierea celulelor. În acest sens, iodothyroninele sunt sinergici ai hormonului de creștere. În plus, T3 accelerează transcripția genei hormonului de creștere. La animalele cu deficiență de T3, celulele hipofizice își pierd capacitatea de a sintetiza hormonul de creștere. Concentrațiile foarte mari de T3 inhibă sinteza proteinelor și stimulează procesele catabolice, după cum indică balanța negativă a azotului. Efectele metabolice ale iodotironinelor sunt atribuite în principal metabolismului energetic, care se manifestă prin creșterea absorbției de oxigen de către celule. Acest efect se manifestă în toate organele, cu excepția creierului, a SRE și a gonadelor. În celule diferite, T3 stimulează activitatea Na +, K + -ATPase, care consumă o parte semnificativă din energia utilizată de celulă. În ficat, iodothyronine accelerează glicoliza, sinteza colesterolului și sinteza acizilor biliari. In T3 ficat și țesutul adipos crește sensibilitatea celulelor la acțiunea adrenalinei și stimulează indirect lipolizei în țesutul adipos și mobilizarea glicogenului în ficat. La concentrații fiziologice de T3 crește absorbția glucozei în mușchi și stimulează sinteza proteinelor și creșterea masei musculare, creste sensibilitatea celulelor musculare la actiunea epinefrinei. Iodothyronine, de asemenea, participă la formarea de răspuns la o creștere a producției de căldură de răcire, creșterea sensibilității sistemului nervos simpatic de a stimula secreția de noradrenalină și noradrenalinei.
Boli ale glandei tiroide Hormonii tiroidieni sunt necesari pentru dezvoltarea normală a unei persoane.
Hipotiroidismul la nou-născuți duce la dezvoltarea cretinismului, care se manifestă prin multiple tulburări congenitale și retard mental mental sever. Hipotiroidismul se dezvoltă datorită deficienței iodotironinelor. De obicei, hipotiroidismul este asociat cu o deficiență a funcției tiroidiene, dar poate apărea și în cazul bolilor hipofizei și hipotalamusului.
Cele mai severe forme de hipotiroidism, însoțite de edemul mucus al pielii și țesutului subcutanat, sunt denumite "mixedem" (din tuja greacă - mucus, edem - edem). Puternicitatea este cauzată de acumularea excesivă de glicozaminoglicani și apă. În țesutul subcutanat se acumulează acid glucuronic și, într-o măsură mai mică, acidul sulfuric de condroitină. Excesul de glicozaminoglicani provoacă modificări în structura coloidală a matricei intercelulare, sporește hidrofilicitatea și leagă ionii de sodiu, ceea ce duce la reținerea apei. Manifestări caracteristice ale bolii: scăderea frecvenței cardiace, letargie, somnolență, intoleranță la rece, piele uscată. Aceste simptome se dezvoltă datorită scăderii metabolismului bazal, ratei de glicoliză, mobilizării glicogenului și grăsimilor, consumului de glucoză de către mușchi, reducerii masei musculare și reducerii producției de căldură. Atunci când apare hipotiroidism la copiii mai mari, se constată un decalaj în creștere fără întârzierea dezvoltării mentale. În prezent, la adulți, o cauză frecventă de hipotiroidism este tiroidita autoimună cronică, ceea ce duce la o întrerupere a sintezei iodothyroninei (goitre Hashimoto).
Hipertiroidismul apare datorită creșterii producției de iodotironine. Gâtul toxic difuz (boala Graves, boala Graves) este cea mai frecventă boală tiroidiană. Cu această boală, se observă o creștere a mărimii glandei tiroide (goiter), o creștere a concentrației de iodotironină de 2-5 ori și dezvoltarea tirotoxicozei. Semnele caracteristice ale tirotoxicozei: creșterea metabolismului bazal, creșterea frecvenței cardiace, slăbiciune musculară, scăderea în greutate (în ciuda creșterii poftei de mâncare). transpirație, febră, tremor și exophthalmos (pop-eyed). Aceste simptome reflectă stimularea simultană cu iodothyronine ca procese anabolice (creștere și diferențiere a țesuturilor) și catabolice (catabolism de carbohidrați, lipide și proteine). Procesele de catabolism sunt mai intensificate, după cum rezultă dintr-un echilibru negativ al azotului. Hipertiroidismul poate apărea ca urmare a diferitelor cauze: dezvoltarea tumorii, tiroidita, consumul excesiv de medicamente care conțin iod și iod, reacții autoimune. Boala lui Graves apare ca urmare a formării anticorpilor antigeni tiroidieni. Una dintre ele, imunoglobulina (IgG), simulează acțiunea tireotropinei, interacționând cu receptorii tirotropinei pe membrana celulelor glandei tiroide. Aceasta duce la o creștere difuză a glandei tiroide și la o producție excesivă necontrolată de T3 și T4. Deoarece formarea IgG nu este reglementată de mecanismul de feedback. Nivelul TSH în această boală este redus datorită suprimării glandei hipofizare prin concentrații ridicate de iodotironine.
120. Reglarea metabolismului energetic, rolul insulinei și hormonilor contrinsulari în asigurarea homeostaziei.
Modificări ale metabolismului în ficat în perioada de absorbție
După consum, ficatul devine principalul consumator de glucoză, provenind din tractul digestiv. Aproape 60 din fiecare 100 g de glucoză transportată de sistemul portal este întârziată în ficat. Consumul crescut de glucoză hepatică - nici un rezultat accelerarea transportului său în celule (transportul glucozei în celule hepatice nu stimulate de insulină), ca urmare a accelerării căilor metabolice, în care glucoza este convertit într-o formă de energie depozitată: glicogen și grăsime. Cu creșterea concentrației de glucoză în hepatocite, are loc activarea glucokinazei, care transformă glucoza în glucoz-6-fosfat. Glucokinaza are o valoare Km înaltă pentru glucoză, care asigură o rată ridicată de fosforilare la concentrații mari de glucoză. În plus, glucokinaza nu este inhibată de glucoza-6-fosfat (vezi pct. 7). Insulina induce sinteza mRNA de glucokinază. O creștere a concentrației de glucoz-6-fosfat în hepatocite determină o accelerare a sintezei glicogenului. Acest lucru este facilitat de inactivarea simultană a glicogenului fosforilazei și de activarea glicogen sintazei. insulina Influențată accelerează glicoliza în hepatocite prin creșterea activității și numărul de enzime cheie: glucokinaza, fosfofructochinază și piruvat kinaza. În același timp, există o inhibare gluconeogenezei ca rezultat inactivarea fructoză-1,6-bisfosfatazei și reducerea fosfoenolpiruvatkarboksikinazy - enzime cheie ale gluconeogenezei. Creșterea concentrației de glucoză-6-fosfat în hepatocite în perioada absorptive, combinată cu o utilizare activă a NADPH pentru sinteza acizilor grași, stimulând astfel calea fosfat pentozo. Accelerarea sintezei acizilor grași furnizează substraturi de accesibilitate (acetil CoA și NADPH), produse de metabolismul glucozei, precum și activarea inducția enzimelor cheie ale sintezei acizilor grași. În perioada de absorbție, sinteza proteinelor este accelerată în ficat. Cu toate acestea, numărul de aminoacizi care intră în ficat din tractul digestiv depășește posibilitățile de utilizare a acestora pentru sinteza proteinelor și a altor compuși care conțin azot. Excesul de aminoacizi fie intră în sânge și sunt transportați în alte țesuturi, fie deaminați cu încorporarea ulterioară a reziduurilor fără azot în calea catabolismului comun.
Modificări ale metabolismului în adipocite. Principala funcție a țesutului adipos este depozitarea purtătorilor de energie sub formă de triacilgliceroli. Sub influența insulinei, transportul de glucoză către adipocite este accelerat. Creșterea concentrației glucozei intracelulare și activarea enzimelor-cheie de glicoliză asigură formarea acetil-CoA și a glicerol-3-fosfatului, necesare pentru sinteza TAG. Stimularea căii fosfatului de pentoză asigură formarea NADPH, necesară pentru sinteza acizilor grași. Cu toate acestea, biosinteza de novo acizi grași în țesutul gras umane are loc la o rată ridicată numai după un post anterior. La un ritm normal de alimentare pentru sinteza TAG, se folosesc acizi grași proveniți din XM și VLDLP sub influența LP-lipazei. Totuși, cu o creștere a raportului insulină / glucagon, lipaza TAG sensibilă la hormon este într-o formă inofensivă defosforilată, iar procesul de lipoliză este inhibat.
Schimbarea metabolismului în mușchi în perioada de absorbție. În perioada de absorbție, influența insulinei accelerează transportul de glucoză către celulele țesutului muscular. Glucoza este fosforilată și oxidată pentru a furniza celulelor energie și este, de asemenea, utilizată pentru a sintetiza glicogenul. Acizii grași, proveniți din XM și VLDL, în această perioadă joacă un rol nesemnificativ în metabolismul energetic al mușchilor. De asemenea, fluxul de aminoacizi în mușchi și biosinteza proteinelor cresc sub influența insulinei, mai ales după consumul de alimente din proteine.
Articole similare
Trimiteți-le prietenilor: