Baterii reîncărcabile
Principiul funcționării unei baterii plumb-acid
Sursa de energie electrică a autovehiculului cu un motor de arbore cotit, care nu funcționează sau cu turație redusă, este o baterie reîncărcabilă. În prezent, bateriile cu plumb sunt utilizate pe scară largă la autoturisme, constând din mai multe baterii conectate în serie. acid baterii Aplicație, deoarece acestea au o rezistență internă mică și sunt capabile pentru o perioadă scurtă de timp (câteva secunde) pentru a da un curent de sute de amperi, este necesar să se furnizeze demarorului la pornirea motorului.
O baterie de plumb-acid electric a fost inventată în 1859 de fizicianul francez Gaston Plante. În anii următori, proiectarea bateriei, în special - compoziția chimică a electrozilor (plăcilor) a fost îmbunătățită constant. În prezent, acumulatorii de plumb și bateriile acumulatoare sunt utilizate pe scară largă în diverse domenii ale tehnologiei ca dispozitive de stocare a energiei (baterii de pornire, surse de energie de urgență și stand-by de energie etc.).
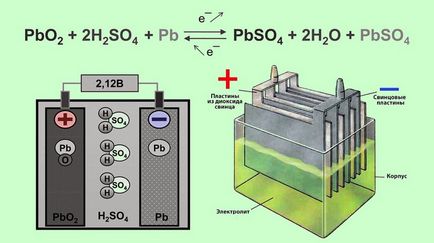
Din punct de vedere structural, bateria este un recipient umplut cu electrolit, în care sunt plasate electrozi de plumb. Ca electrolit, se utilizează o soluție de acid sulfuric și apă distilată. Electrozii sunt realizați sub formă de plăci, dintre care unul este realizat din plumb spongios Pb. iar al doilea - din dioxid de plumb PbO2. Când electrozii interacționează cu electrolitul, apare o diferență de potențial între ele.
Principiul de funcționare a bateriilor plumb-acid se bazează pe reacțiile electrochimice ale plumbului și dioxidului de plumb într-o soluție apoasă de acid sulfuric.
Când sarcina externă este conectată la electrozi, începe reacția electrochimică a interacțiunii dintre oxidul de plumb și acidul sulfuric, în timp ce plumbul metalic este oxidat la sulfat de plumb.
În timpul descărcării, dioxidul de plumb este redus pe electrodul pozitiv (anodul) și oxidarea plumbului pe electrodul negativ (catod). Când curentul de încărcare trece prin electrozii bateriei, apar reacții inverse. Când bateria este reîncărcată, după epuizarea sulfatului de plumb începe electroliza apei, cu eliberarea de oxigen la anod și hidrogenul la catod.
Reacții electrochimice (de la stânga la dreapta - cu descărcare, din dreapta spre stânga - cu încărcare):
Reacțiile asupra anodului:
Reacțiile pe catod:
Procesele fizice care apar în acumulator sunt explicate prin proprietatea dizolvării electrolitice a metalelor, care constă în trecerea ionilor metalici încărcați pozitiv în soluție. Metalele oxidante ușoare (de exemplu, plumbul) au această proprietate într-o măsură mai mare decât metalele inerte.
Când electrodul de plumb este scufundat în soluția electrolitică, ionii de plumb încărcați pozitiv vor începe să se separeze de el și să treacă în soluție, în timp ce electrodul însuși va fi încărcat negativ.
Odată cu trecerea procesului, diferența de potențial dintre soluție și electrod crește, iar trecerea ionilor pozitivi în soluție va încetini.
Atunci când o anumită diferență de potențial între electrod și soluția unui echilibru între forța elastică a dizolvării electrolitică a plumbului, pe de o parte, și forțele câmpului electrostatic și a presiunii osmotice - altele.
Ca urmare, tranziția ionilor de plumb către electrolit va înceta.
Când se scufundă un electrod făcut din dioxid de plumb, se observă un proces similar în soluția de acid sulfuric, dar rezultatul este diferit. Dioxidul de plumb într-o cantitate limitată trece într-o soluție în care, atunci când este combinată cu apă, este ionizată în ioni de plumb tetravalent Pb4 + și ioni hidroxil OH monovalenți.
Ionii tetravalenți de plumb, depozitați pe electrod, creează un potențial pozitiv în raport cu soluția. Acidul sulfuric se formează în apă practic numai pe ionii HO + și HSO4.
Astfel, atunci când bateria este descărcată, se consumă acid sulfuric, se formează apă și se formează sulfat de plumb pe ambii electrozi. Când se încarcă, procesele se desfășoară în direcția opusă.
La conectarea consumatorilor în baterie, există un curent de descărcare. În acest caz, ionii reziduului de acid sulfuric S04 sunt legați la plumbul electrozilor și formează pe acestea sulfat de plumb PbS04. iar ionii de hidrogen se combină cu oxigenul, în picioare pe placa pozitivă sub formă de apă.
Ca rezultat, electrozii sunt acoperiți cu sulfat de plumb, iar acidul sulfuric este diluat cu apă, adică atunci când bateria este descărcată, densitatea electrolitului scade. Prin urmare, densitatea electrolitului poate fi utilizată pentru a evalua gradul de încărcare a bateriei.
După finalizarea proceselor de recuperare a plumbului pe electrozi, încărcarea bateriei se oprește. După trecerea în continuare a curentului electric prin procesul electrolitic electroliza începe (expansiune) a apei, în timp ce bateria „fierbe“ și forma bule evoluat un amestec de hidrogen și oxigen. Amestecul acestor gaze este exploziv, prin urmare este necesar să se evite supraîncărcarea înainte de apariția fenomenelor de electroliză la descompunerea apei.
În plus, reîncărcarea prelungită duce la pierderea electrolitului de apă (evaporare), în urma căreia crește densitatea și pentru ajustarea este necesară pentru a umple apa distilată.
La adăugarea de apă trebuie amintit faptul că apa care intră acidul sulfuric concentrat, cu punct de fierbere și picăturile spray-uri puternic acide, care intră în contact cu un corp deschis sau îmbrăcăminte poate provoca arsuri ale pielii, mucoaselor arde hainele și alte consecințe neplăcute.
Cu o tensiune constantă a sursei curentului de încărcare, pe măsură ce crește starea de încărcare a bateriei, EMF crește și, în consecință, curentul de încărcare scade. Când tensiunea la bornele sursei de curent este egală cu emf-ul bateriei complet încărcate plus emf de polarizare, curentul de încărcare se va opri.
Valoarea medie a tensiunii bateriei - 2 B. Deoarece vehiculele moderne electrice proiectate să funcționeze la o tensiune a sistemului de 12 sau 24 V baterii combinate într-o baterie (6 sau 12 buc.).
Un parametru important al bateriei este capacitatea sa, adică cantitatea de energie electrică pe care o poate furniza bateria. Capacitatea este rezultatul rezistenței curentului de descărcare pentru durata descărcării până la starea maximă admisă. Se măsoară capacitatea bateriei în ore de amperi (A × h). Capacitatea bateriei depinde, în primul rând, de zona activă a electrozilor.
Prin urmare, creșterea capacității poate fi realizată prin creșterea suprafeței electrodului care se realizează prin utilizarea mai multor plăci paralele interconectate, iar aplicarea materialului poros pentru fabricarea lor, care permite utilizarea ca masa activă, nu numai la suprafață, ci și volumul intern al plăcilor.
Capacitatea bateriei nu este constantă, depinde de rezistența curentului de descărcare, de temperatura electrolitului și de starea suprafeței active a plăcilor. Prin creșterea curentului de descărcare, și temperatura electrolitului scade capacitatea bateriei scade datorită unei descărcări incomplete a reacțiilor electrochimice în aceste condiții, datorită reducerii timpului de descărcare și de a spori vâscozitatea electrolitului la temperaturi scăzute.
Articole similare
-
Instalarea, principiul de funcționare și controlul regulatorului de turație
-
Convertor de frecvență, bază teoretică, principiu de funcționare
-
Dispozitivul de dezumidificare a aerului adsorbant și principiul de funcționare
Trimiteți-le prietenilor: