Lecție practică 3. Obținerea amoniacului și studierea proprietăților sale. Cunoașterea proprietăților unei soluții apoase de amoniac
Rezolvarea problemelor la diferite subiecte
Starea sarcinii: Lecție practică 3. Obținerea amoniacului și studierea proprietăților sale. Cunoașterea proprietăților unei soluții apoase de amoniac
Numărul sarcinii 3
Alocări. 1. Obțineți amoniac din reacția hidroxidului de calciu cu clorura de amoniu.
2. Studiați câteva proprietăți fizice ale amoniacului (culoare, miros, densitate relativă, solubilitate în apă).
3. Studiați interacțiunea amoniacului cu apă, acid azotic și acid clorhidric.
4. Procedați după cum urmează: a) între soluția de amoniac în apă și acidul sulfuric, b) între hidroxid de amoniu și soluție de clorură ferică.
Respectați regulile de siguranță atunci când efectuați experimente!
Echipamente. Detaliile dispozitivului pentru producerea de amoniac, trepied laborator stativ cu tuburi, mojar cu un pistil, o spatula sau lingura, tije de sticlă (2 buc.), Suportul de tub, un încălzitor.
Substanțe. Hidroxid de calciu cristalin și clorură de amoniu; clorhidrat concentrat, azot concentrat și acid sulfuric 20%; apă (într-un pahar), soluție de fenolftaleină, soluție de clorură ferică (III).
Performanța muncii
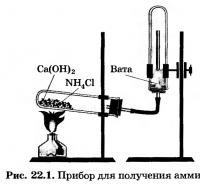
Obținerea amoniacului. Asamblați dispozitivul pentru a produce amoniac (figura 22.1), pentru a detecta scurgeri. pentru
fixați-l într-un trepied astfel încât să fie convenabil să încălziți tubul. Decideți ce poziție a tubului de încercare (figura 22.2, a, b, c sau d) este corectă.
Pregătiți trei tuburi uscate (de ce?) Care trebuie umplete cu amoniac. Închideți-le cu dopuri.
Într-un mortar, se toarnă o lingură de clorură de amoniu și hidroxid de calciu, se amestecă, se lipește cu un pistil. Apoi transferați partea din amestec în tubul aparatului, umpleți-l cu cel mult 1/3.
Începeți încălzirea conținutului tubului, mai întâi încălziți întregul tub cu flacăra arzătorului, apoi îndreptați flacăra astfel încât suprafața amestecului să se încălzească.
Umpleți cele trei tuburi cu amoniac, conectați-le cu dopuri și suporturi; Opriți încălzirea și, fără a dezasambla dispozitivul, transferați-o într-o hota de fum.
Studiul proprietăților amoniacului.
1. Investigați solubilitatea, interacțiunea dintre amoniac și apă. Pentru a face acest lucru, reduceți eprubeta cu amoniac într-un pahar cu apă și deschideți-o sub apă, așa cum se arată în Figura 22.3.
Ce cauți?
Fără a scoate eprubeta, închideți-o și sub apă cu un dop cu un suport, apoi puneți-l într-un trepied. La soluția obținută se adaugă 2-3 picături de soluție de fenolftaleină.
Scrieți ecuația pentru reacția amoniacului cu apa.
2. Umpleți tija de sticlă cu acid clorhidric concentrat, cealaltă cu acid azotic concentrat. Se pipetează câte unul câte unul în tuburi cu amoniac. Ce cauți?
Realizați ecuațiile pentru reacțiile care apar.
De ce experiența nu va funcționa cu acizi sulfurici și fosforici?
3. Se toarnă soluția apoasă de amoniac rezultată în apă în două eprubete. Într-un singur tub se adaugă câteva picături de soluție de fenolftaleină și se toarnă ușor acidul sulfuric până când culoarea indicatorului dispare. Ce cauți?
Scrieți ecuațiile pentru reacțiile de formare a sulfatului de amoniu și a sulfatului de hidrogen.
4. Se adaugă o soluție de clorură de fier (III) într-un alt tub cu soluție de amoniac. Ce cauți?
Notați ecuațiile ionice ale reacțiilor.
Producția de amoniac:
Poziția corectă a tubului de sub b). Mai întâi, NH3 este mai ușor decât aerul, acesta va merge în sus, astfel că și conducta de aerisire trebuie să fie orientată în sus. În al doilea rând, vom încălzi substanța într-un tub de testare, astfel încât să nu vină în contact cu un tub de testare care se poate topi de la foc.
Tuburile trebuie să fie uscate, deoarece amoniacul reacționează cu apă și, ca rezultat, se formează hidroxid de amoniu.
Reacția producției de amoniac:
Studiul proprietatilor amoniacului:
Amoniacul este ușor solubil în apă:
2.
3.
Soluția este decolorată, deoarece acidul sulfuric neutralizează amoniacul, adică mediul devine neutru. Într-un mediu neutru și acid, fenolftaleina este incoloră.
4.
Îmi place lecția practică 3. Obținerea amoniacului și studierea proprietăților sale. Cunoașterea proprietăților unei soluții apoase de amoniac?
Găsiți soluția oricărei probleme
Site-ul nostru este conceput pentru a vă ajuta să rezolvați problemele educaționale, cum ar fi rezolvarea problemelor din fizică. Aici puteți să veniți și să găsiți o soluție pentru sarcina dvs. specifică sau să găsiți o soluție similară și să înțelegeți cum să vă rezolvați problema. Fiecare elev are nevoie de ajutor, toată lumea caută cea mai ușoară cale de a atinge obiectivul și el va fi găsit întotdeauna dacă este persistent și căutător.
Articole similare
Trimiteți-le prietenilor: