Funcțiile de stare sunt cantități fizice complexe care nu sunt direct măsurabile și se calculează prin parametrii de stare. În termodinamica tehnică, se folosesc următoarele funcții de stat: energia internă, entalpia, entropia.
Parametrii și funcțiile stării gazelor au întotdeauna aceeași valoare în această stare, indiferent dacă se realizează în timpul răcirii sau încălzirii, extinderii sau comprimării gazului.
Energia internă U este rezerva de energie, pe care corpul o are în starea de echilibru. In procedeele studiate tehnice termo dinamică, schimbarea internă a energiei are loc prin schimbarea corpului energetic stocul intern termic, care este suma energiei cinetice a moleculelor de agent de translație, rotație și oscilantă-mișcare-inflamatorii și potențialul energetic al lor inter-acțiune. Energia cinetică internă depinde de temperatura corpului și crește odată cu creșterea acesteia. Energia internă potențială depinde de distanța dintre molecule și crește, pe măsură ce se apropie una de alta, adică depinde de presiune și densitate. Astfel, energia internă este o funcție a parametrilor care determină starea corpului. În cazul gazelor ideale în care nu există forțe de interacțiune a moleculelor, schimbarea energiei interne se va datora numai modificării energiei cinetice a mișcării moleculelor, adică pentru un gaz ideal
Entalpie. Corpurile, proprietățile și comportamentul macroscopic, care sunt studiate prin termodinamică, sunt în interacțiune cu corpurile din jur. Totalitatea energiei interne a corpului și energia interacțiunii externe a corpului cu mediul este unită de conceptul de "en-
În notația matematică, entalpia este dată de
unde U este energia internă a sistemului; pV este energia potențială a presiunii mediului pe sistem, exprimată în parametrii sistemului.
Din ecuația de stare a unui gaz ideal (2.5), produsul pV poate fi
înlocuiți cu RT. și apoi
Entalpia unui gaz ideal depinde numai de temperatura,
Energia internă și entalpia, care se referă la o unitate de masă a materiei, se numesc specifice (u și i), a căror unitate de măsură este J / kg.21
Entropia este un semn al schimbului de energie sub formă de căldură. Schimbarea valorii entropiei caracterizează prezența schimbului de căldură între sistem și mediu. Când se aplică căldură corpului, entropia sa crește, iar atunci când este retrasă, acesta scade. Entropia unui sistem izolat în echilibru rămâne neschimbată.
Entropia este notată cu S și are dimensiunea J / K; entropia specifică este dată de s. dimensiunea sa este J / (kg · K).
Funcțiile de stare u. i. s sunt cantități pozitive. În procesele studiate prin termodinamica tehnică, nu este de obicei necesar să se determine valorile lor absolute, însă este suficient să se determine numai variația acestor cantități. Prin urmare, pentru originea pentru u. i. s puteți accepta orice stare arbitrară a sistemului. În termodinamică se acceptă în mod convențional că valorile energiei interne, entalpiei și entropiei în condiții fizice normale sunt zero.
Lucrarea efectuată atunci când starea gazului se schimbă, se calculează prin formula
unde p este presiunea gazului, caracterizând forța gazului pe mediul înconjurător, Pa; V este schimbarea volumului gazului, care caracterizează mișcarea mecanică a limitelor corpului, m 3.
Presiunea într-un sistem termodinamic este motivul pentru care lucrează. Extinderea sau contracția gazului este posibilă numai atunci când presiunea sistemului diferă de presiunea ambientală. Un semn al lucrării schimbă volumul sistemului. Lucrarea este pozitivă dacă gazul se extinde și este negativ dacă gazul este comprimat.
Pentru reprezentarea grafică a lucrării se utilizează o diagramă numită diagrama de lucru, unde cantitatea de lucru este măsurată de zona de deasupra curbei schimbării volumului fluidului de lucru în proces (figura 2.1).
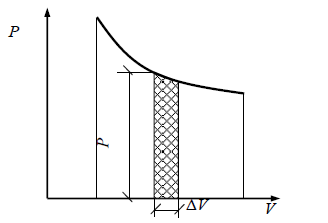
Fig. 2.1. Reprezentarea grafică a funcționării gazului (diagrama de funcționare)
Căldura. Cantitatea de căldură pe care sistemul o schimbă cu mediul în care schimbările de stare sunt determinate din exprimare
unde T este temperatura; S este schimbarea entropiei sistemului.
Temperatura proceselor, însoțită de schimbul de căldură, este cauza schimbului de energie sub formă de căldură. Schimbul de căldură între corpuri este posibil numai în prezența unei diferențe de temperatură.
Semnul transferului de căldură este schimbarea entropiei. Creșterea entropiei indică furnizarea de căldură către sistem (căldura este pozitivă), o scădere a eliminării căldurii din sistem (căldura este negativă), constanța entropiei este absența schimbului de căldură.
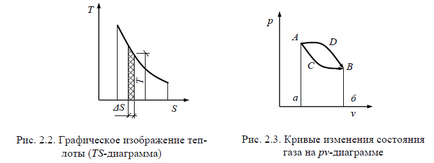
Pentru reprezentarea grafică a cantității de căldură se utilizează o diagrama numită termică, unde cantitatea de căldură este măsurată de suprafața sub curba de schimbare a entropiei atunci când starea corpului se schimbă (figura 2.2). Lucrările și căldura atribuite unui gaz de 1 kg sunt indicate prin simbolurile liniei, respectiv l și q și sunt măsurate în J / kg.
Starea sistemului în pv - și TS - diagramele este reprezentată de un punct, iar procesul de către o curbă a tranziției sale de la starea inițială la cea finală.
În Fig. 2.3 Tranzițiile sistemului de la statul A la statul B sunt realizate în diferite moduri: de-a lungul curbei ADB și ACB. Zonele din aceste curbe sunt diferite, prin urmare, cantitățile de lucru și de căldură sunt diferite. În același timp, stările inițiale și finale ale sistemului în ambele procese sunt aceleași (punctele A și B).
Astfel, munca și căldura se manifestă doar în procesul de schimbare a stării și depind de natura procesului.
În sistemul termodinamic, rolul dominant este jucat de schimbarea energiei interne, exprimată în cantitatea de muncă și de căldură pe care o schimbă cu mediul. În acest caz, sistemul își mărește energia internă dacă îi este furnizată căldură (sau se lucrează la ea) și își reduce energia internă dacă eliberează căldură în mediul înconjurător (sau funcționează asupra mediului).
adică schimbarea energiei interne a sistemului este egală cu diferența dintre cantitatea de căldură și munca pe care sistemul o schimbă cu mediul.
Cu alte cuvinte, toată căldura furnizată corpului de lucru
Încearcă să schimbe energia internă și să efectueze munca de schimbare a volumului:
Articole similare
Trimiteți-le prietenilor: