În procesul de activitate vitală în orice organism viu, se realizează cele mai complexe și variate transformări ale substanțelor chimice de natură diferită. Majoritatea covârșitoare și, conform unor date, chiar toate reacțiile chimice din organismele vii apar cu participarea catalizatorilor biologici - enzimelor. Aceasta explică ușurința de a trece aceste reacții.
Cataliza enzimatică este semnificativ diferită de cea a catalizei chimice. Aceste diferențe sunt după cum urmează.
Activitate catalitică. Prin activitate, catalizatorii biologici sunt de milioane de ori mai mari decât activitatea catalizatorilor chimici. Chiar și cel mai bun catalizator anorganic, platina atomică, este inferior, spre exemplu, enzimei catalazice în activitate pe mie de centre active pe mie. Rata reacțiilor enzimatice poate fi evaluată prin următorul exemplu: 1 mol de enzimă de zaharoză este capabilă să se împartă în 1 cu 1000 moli de zahăr din sfeclă.
Cantități nesemnificative de enzime sunt capabile să împartă cantități uriașe de substanțe care reacționează. Astfel, 1 g de clivează pepsinului cristaline 50 kg de ou coagulat albe, și 1 g de renina cristalin sub formă de rulouri 72 tone de lapte. Enzima peroxidază, care accelerează oxidarea substratului cu peroxid de hidrogen, este activă la o diluție de 1% în greutate. o enzimă de 500.000.000% în greutate. h. apă.
Conform recomandărilor Comisiei internaționale privind activitatea catalitică rotundă Enzime nomenkla a enzimei poate fi caracterizată prin „activitate moleculară“ sa, prin care trebuie să se înțeleagă numărul de molecule de substrat sau echivalență-ing grupurile afectate per 1 minute convertește o moleculă de enzimă la o concentrație optimă de substrat.
Specificitate chimică ridicată. Spre deosebire de catalizatorii chimici, enzimele au o specificitate mult mai mare: fiecare acționează numai pe baza unei reacții sau a unui grup de reacții definite strict în organism. Se presupune că aproximativ 1000 de enzime diferite funcționează simultan în corpul uman. În același timp, ele formează sisteme enzimatice complexe care asigură fluxul unui număr de reacții strict consecutive și coordonate în celula vii. Dacă enzimele nu ar avea o specificitate atât de mare, acest lucru ar duce la o descompunere rapidă a tuturor substanțelor din celule și la moartea întregului organism.
Specificitatea enzimelor este împărțită în cantități absolute (sau chimice) și stereochimice.
Absolut specific este acțiunea fiecărei enzime pe o substanță a unei compoziții chimice strict definite. De exemplu, enzima urează catalizează numai hidroliza ureei, enzima pepsină este doar decuplarea proteinelor, catalaza acționează numai asupra peroxigenului de hidrogen.
Specificitatea stereochimică constă în faptul că enzimele acționează numai asupra anumitor stereoizomeri ai compușilor organici. Ca exemplu al acestei specificități, putem evidenția acțiunea a două enzime: # 945; - și # 946; -glucozidază. Fer-cop # 945; -glucozidaza acționează numai pe # 945; -glucozide și #glucozidaza - on Glicozide, așa cum se poate observa clar în diagrama de mai sus:
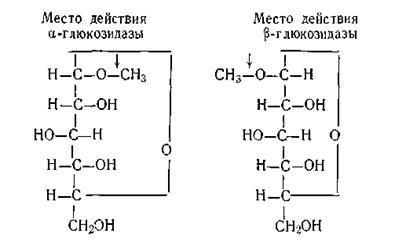
Motivele pentru această specificitate ridicată a enzimelor nu au fost încă explorate pe deplin. Există o serie de teorii care explică mecanismul de acțiune al enzimelor.
Astfel, chimistul german Fisher, pentru a explica specificitatea enzimei în raport cu un substrat dat, a propus o dată ipoteza "blocare și cheie". Conform acestei ipoteze, molecula substratului corespunde exact formei sale pe un anumit sit al moleculei de enzimă. Fischer credea că "cheia" - substratul exact - se duce la enzimă - "blocarea" fără nici o formă de rupere a celor două molecule. Cu toate acestea, studiile au arătat că, într-o serie de cazuri, ipoteza lui Fisher nu poate explica unele fapte.
Pentru a aduce această teorie în concordanță cu datele experimentale, Koshland a modificat într-o oarecare măsură modelul de blocare a cheilor. Potrivit ipotezei sale, substratul, care se alătură centrului activ, își schimbă forma, asigurându-și astfel corespondența ideală. Cu alte cuvinte, grupurile funcționale din centrul activ presupun o configurație spațială specifică numai atunci când sunt forțate să facă acest lucru prin prezența unui substrat.
Astfel, formarea unui complex enzimă-substrat poate să apară datorită grupărilor încărcate electric atât pe enzimă, cât și pe substrat. Astfel de grupări pot fi
Ca rezultat al acestei interacțiuni, pot apărea anumite modificări chimice în substrat, ducând la formarea de noi grupe funcționale cu proprietăți polare complet diferite. După reacție, enzima și substratul par să se retragă una de alta și enzima este din nou gata să interacționeze cu o altă moleculă a substratului. Un substrat modificat chimic scinde produsul de reacție.
Astfel, specificitatea enzimei se datorează configurației sale, structurii și proprietăților electrice ale grupului activ al enzimei.
Inactivare. În procesul de reacție catalitică, enzima se dezintegrează treptat și își pierde activitatea. Acest fenomen se numește inactivare. Experiența arată că, cu cât este mai activă enzima, cu atât se descompune mai mult în timpul catalizei. Aceste enzime de proprietate sunt semnificativ diferite de catalizatorii anorganici, care, așa cum s-a menționat deja, rămân neschimbate în produsele reacției.
Structura enzimelor. În comparație cu catalizatorii anorganici, enzimele au o structură mult mai complexă. Fiecare enzimă conține o proteină care este responsabilă pentru specificitatea ridicată a catalizatorilor biologici. Prin structura lor, enzimele sunt împărțite în două mari clase: una și două componente. Enzimele cu un singur component sunt compuse numai din corpuri de proteine, care au proprietăți catalitice. În aceste enzime, rolul grupurilor active se realizează prin anumite fragmente chimice care fac parte din molecula de proteine și se numesc centre active.
În prezent, peste 100 de enzime monocomponente cunoscute pentru
Este în formă cristalină.
Enzimele cu două componente sunt cele care constau dintr-o parte proteică și non-proteică numită grup protetic. Sa sugerat că grupul protetic activ este numit agon, iar purtătorul de proteine este feron, sau altfel apoenzima. Studiile au arătat că partea proteică a unei enzime bicomponente (feron) are o influență decisivă asupra specificității acțiunii sale. În același timp, combinarea unui grup activ cu o proteină conduce la o creștere enormă a activității sale catalitice.
De asemenea, sa demonstrat că rezistența legăturii dintre agon și feron este diferită pentru enzimele diferite. Unele enzime, cum ar fi dehidrogenaze catalizează oxidarea diferitelor substraturi, ny retragerea de hidrogen (dehidrogenarea) această conexiune este fragilă-TION. Astfel de enzime disociază ușor și se descompun în agon și feron. La sugestia proeminent biochimist francez G. Bertrand, agonie, este ușor separată de partea de proteine a fermei-TA, denumită de obicei co-enzime.
Ca un exemplu pot fi menționate două enzimă decarboxilaza component enzimă piruvatului care cliveaza acidul piruvic la acetaldehida și monoxid de carbon (IV):
Natura chimică a grupului activ de piruvat decarboxilază este acum complet elucidată. Este un compus al unei molecule de vitamina B1 și două reziduuri de acid fosforic. Pyruvat decarboxilaza este un exemplu al unei enzime a cărei grupă activă conține o vitamină. După cum arată studii, vitaminele sunt parte integrantă a unui număr de enzime importante (catalază, peroxidază etc.).
Influența condițiilor externe. Prin natura lor, enzimele sunt semnificativ mai sensibile la modificările condițiilor de mediu decât catalizatorii anorganici. În special, enzimele "funcționează" într-un interval de temperatură mult mai restrâns. Optimul de temperatură dintre cele mai de plante enzime 313-333 K, enzime belly-TION 313-323 C. Dacă temperatura depășește, activitatea enzimei pre-ly scade rapid, iar la 343-353 K este distrugerea lor ireversibilă cauzată de denaturarea proteinei-TION. Numai foarte puține enzime sunt capabile, în anumite condiții, să reziste încălzirii la 373 K fără pierderea activității.
Catalizatorii anorganici, după cum arată experiența, pot funcționa independent și la temperaturi mai ridicate - până la câteva sute de grade.
Spre deosebire de catalizatorii anorganici, enzimele își manifestă activitatea într-un domeniu strict definit de pH al mediului. În tabel. 2.1 arată pH-ul la care diferite enzime își manifestă activitatea maximă.
După cum se poate vedea din acest tabel, intervalul valorilor pH-ului este foarte larg pentru activitatea diferitelor enzime. Efectul pH-ului asupra activității enzimatice este explicat prin modificarea stării de ionizare nu numai a enzimei și substratului, ci și a complexului enzimă-substrat.
Diferitele enzime au un pH optim diferit.
Enzimele din diferite culturi au diferite valori optime ale pH-ului:
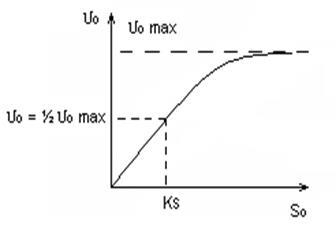
Orezul 4.5 Grâu 6.0 Într-o viziune generală: Vkat. = f (T, pH) Kinetica reacțiilor biochimice este descrisă de ecuația lui Michaelis-Menten. Michaelis și Menten au studiat viteza de reacție a hidrolizei ATP cu miozină. Proteinele actin, myosin și ATP joacă un rol decisiv în procesul contracțiilor musculare. Hidroliza ATP → ADP + F + E E - această energie este utilizată în contracțiile musculare. Substrat ATP (reactiv); unde # Rata inițială de reacție; 0max este rata inițială de reacție determinată teoretic la concentrația maximă a substratului; S0 este concentrația inițială a substratului; KS este concentrația substratului la care: # 965; 0 = ½ # 965; 0max 1) pentru S0 mic, dependența # 965; 0 = f (S0) este liniară (se supune ecuației de reacție # 921; Th); 2) pentru S0 »KS, o reacție de ordin zero față de concentrația substratului, adică viteza inițială nu depinde de concentrația substratului, are loc saturația.
Articole similare
Trimiteți-le prietenilor: