Când cufundat placa de metal liber al filmului de oxid într-o soluție de electrolit la metal - soluție de electrolit strat dublu electric (EDL), caracterizat printr-o anumită diferență de potențial sau un anumit potențial de electrod.
Ca urmare a tranziției particulelor încărcate prin interfața a două faze, metalul (M), faza solidă (t), soluția de electrolit (g), apare ca urmare a tranziției. Când se formează, de exemplu, în cazul unei plăci metalice scufundate în apă, apar următoarele procese:
1. Separarea ionilor încărcați pozitiv (cationi) de pe suprafața metalului și tranziția lor în soluție.
2. Excesul de electroni rămași în metal își încarcă suprafața negativ.
3. Hidratarea cationilor de către moleculele de apă polară, în volumul fazei lichide (solvatare prin molecule de solvent)
M + nHO-M-nHO
Procesele de mai sus (1,2,3) apar simultan și prin urmare ecuația lor generală poate fi scrisă:
4. Concentrarea cationilor hidrați (solvatați) în stratul lichid adiacent la suprafața metalică datorită interacțiunii lor cu o suprafață încărcată negativ. Cationii încărcați pozitiv sunt atrași de o suprafață încărcată negativ. Formată DES, caracterizată de potențialul electrodului.
5. Odată cu creșterea saltului potențialului dintre metal și soluția electrolitică, procesele inverse, deshidratarea ionilor metalici și reducerea lor ulterioară la atomi încep să curgă la o rată mai mare.
6. La un anumit salt în potențial, există un echilibru:
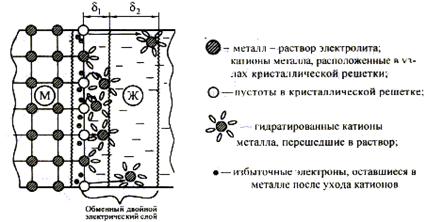
Fig. 12. Diagrama apariției unui strat electric dublu schimbător și a potențialului electrodului la limita soluției metal-electrolitice.
Potențialul electrodului de echilibru (sau pur și simplu potențialul electrodului) reprezintă saltul potențial stabilit între metal prin soluția de electrolit în condiții de echilibru.
Amploarea potențialului de electrod, iar grosimea stratului dublu electric depinde de natura metalului, temperatura și activitatea (concentrația) a ionilor în soluție. DES are o structură difuză, astfel încât valoarea absolută a potențialului electrodului nu poate fi determinată. Cu toate acestea, dacă folosim electrodul de referință, care potențial se presupune în mod convențional, (E1 = 0 (V)), este posibil să se calculeze potențialele Semicelulă necunoscute ale electrodului (E2) în raport cu electrodul de referință cu ajutorul ecuației de zero: emf (DE) = E1 - E2.
În practică, se folosește valoarea relativă (condiționată) a potențialului de echilibru al electrodului. denotată de.
Relativ potențial de electrod standard, - este egală cu mărimea forței electromotoare a unei celule electrochimice constând dintr-un electrod scăzut într-o soluție de ioni metalici cu activitate egală cu 1 mol / litru, la 25 0 C (298K), când P = 3.1.10 5 Pa și electrodul de referință.
Un electrod standard de hidrogen este utilizat ca electrod de referință (figura 2). Structurale constă dintr-o placă platină (acoperită cu un strat de platină electrolitică - negru de platină), parțial imersată într-o soluție care conține ioni de hidrogen (de obicei o soluție de H2S04 sau HCI). Plăcuța este alimentată cu gaz hidrogen pur la presiune constantă. Într-un mediu acid, electrodul hidrogen este H3O + / H2. Pt corespunde ecuației procesului de electrozi 2H3O + (g) +2H2 (G) + 2H2O (g). care într-o formă simplificată este scrisă: 2H + (x) + H2 (T).
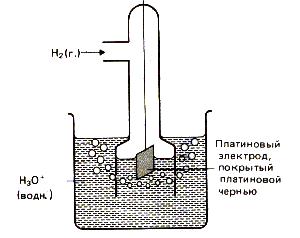
Figura 13. Electrodul de hidrogen.
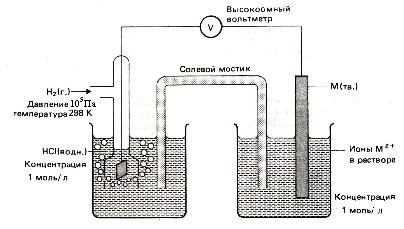
Figura 14. Măsurarea potențialului electrodului standard
În reprezentarea schematică, electrodul de hidrogen este reprezentat după cum urmează: dacă platina servește ca anod sau
, dacă platina servește drept catod.
Utilizarea unui electrod hidrogen face posibilă măsurarea potențialului relativ de electrod al oricărei jumătăți de celulă, constituind o sursă de curent chimic (figura 3).
Dacă electrodul hidrogen joacă rolul unui electrod negativ, înregistrarea schematică a sursei de curent chimice astfel constituită are forma: A - PtêH2 (g) êH + (g) êêMn + (g) êM (m) K +. Prin urmare,
Dacă electrodul hidrogen joacă rolul unui electrod pozitiv. A-M (m) êMn + (g) êê H + (g) ê H2 (g) ê Pt K +. atunci.
Astfel, potențialul electrodului standard al jumătății de celule considerate este egal cu cel emf standard. o sursă chimică constând din acest semi-element și un electrod standard de hidrogen.
În condiții nestandard, potențialul electrodului este calculat din ecuația Nernst:
(OF) - formă oxidată;
(WF) - forma restabilită;
R = 8,314 J / K. mol (constantă de gaz universal);
E 0 este potențialul relativ standard al electrodului (date tabulare); măsurată în volți (V);
T este temperatura absolută (298 K);
Numărul F al lui Faraday, egal cu 96500 (Cl / mol);
n este numărul de electroni implicați în proces;
Concentrația molară a cationilor metalici (mol / l).
E = E 0 + 0,059 / n. lgCMe n +, dacă CMe n + = 1 mol / l, atunci E = E 0.
Sarcina. Se calculează potențialul de electrozi al plăcii de aur care a căzut într-o soluție de sare cu o concentrație de [Au 3+] egală cu 0,1 mol / l.
Deoarece condițiile descrise în problemă diferă de cele standard, adică Cau 3+ 1 mol / l și este de 0,1 mol / l de către starea problemei, prin urmare, pentru a calcula potențialul electrodului, este necesar să se utilizeze ecuația Nernst:
Conceptul de potențial electrod standard este introdus pentru a compara proprietățile de oxidare-reducere ale diferitelor sisteme cu potențialele lor standard.
În concordanță cu valorile potențialului electrodului standard, a fost elaborată o serie electrochimică de solicitări metalice.
K Ca Mg Al Zn Fe Pb H + Cu Ag Au
1. Toate metalele care stau în stânga hidrogenului. au valori negative ale potențialului electrodului standard. mai bine-pozitiv. Acordul privind semnele de potențial a fost adoptat în 1953. la Congresul Uniunii Internaționale de Chimie Pură și Aplicată (IUPAC). Am convenit să atribuim potențialul acestui semn. care are un electrod cuplat cu un electrod standard de hidrogen.
2. Valorile negative indică faptul că aceste metale sunt agenți reducători în ceea ce privește hidrogenul, adică ele sunt deplasate (reduse din soluțiile de acizi minerali cu = 1 mol / l, ale căror anioni nu prezintă proprietăți oxidante (HCI, HSO))
Zn + 2HCI -> ZnCI + H ↑; E 0 Zn n + / Zn = -0,763 B
și descompun apă
3. Cu cât valoarea potențialului electrodului este mai negativă, cu atât este mai mare capacitatea metalului de a-și da ioni soluției, adică cu atât mai pronunțată este capacitatea redusă a formei sale reduse (abilitatea de a da electroni) și capacitatea de oxidare a formei sale oxidate (abilitatea de a primi electroni) este mai mică.
4. O valoare pozitivă a potențialului înseamnă că acești ioni metalici sunt oxidanți față de hidrogen, i. E. Nu descompuneți apa și nu o înlocuiți din soluții în care = 1 mol / l. Dimpotrivă, hidrogenul înlocuiește metalele din soluțiile sărurilor lor.
5. Printre metalele cu o valoare pozitivă a potențialului electrodului standard, fiecare metal anterioară înlocuiește toate soluțiile ulterioare din sărurile lor. De exemplu: Cu + HgCl2 → CuCl2 + Hg.
Articole similare
Trimiteți-le prietenilor: