Centrul activ al enzimelor cu specificitate absolută a substratului este complementar unui singur substrat. Trebuie remarcat că astfel de enzime în organismele vii sunt puține.
enzimă EXEMPLU cu specificitate de substrat absolut - arginase, arginina catalizează reacția de scindare a ureei și ornitina: Un alt exemplu al unei enzime cu o specificitate de substrat absolut - ureazei catalizează hidroliza ureei în dioxid de carbon și amoniac.
Gruparea specificității substratului
Cele mai multe enzime catalizează același tip de reacție cu o cantitate mică (bandă) este substraturi similare structural. Astfel, enzima lipaza pancreatică catalizează hidroliza grăsimilor în duoden, catalizând conversia oricăror molecule de grăsime (triacilglicerol) la molecula monoatsilglitserola și două molecule de acizi grași superiori. Lipaza pancreatică hidrolizează legătura esterică în # 945; - gama de carbon glicerol, indiferent de ce acizi grași fac parte din molecula de grăsime
Majoritatea enzimelor proteolitice care efectuează hidroliza proteinelor au specificitatea substratului în grup, hidrolizând legăturile peptidice formate de diverși aminoacizi.
Dacă un substrat are mai mulți stereoizomeri, enzima prezintă specificitatea absolută a uneia dintre ele. În organismul uman se observă specificitatea enzimelor la următorii stereoizomeri.
· Stereospecificitate la D-zaharuri. Cele mai multe monozaharide și produsele lor metabolice la om și la alte mamifere sunt denumite stereoizomeri D. Enzimele care le metabolizează au o specificitate pentru D-, nu L-zaharuri.
· Stereospecificitate față de L-aminoacizii. Proteinele umane constau din aminoacizi din seria L. Majoritatea enzimelor care transformă aminoacizii au o stereospecificitate față de L-aminoacizii.
· Stereospecificitatea la cisstransizomerii. Enzima fumarazică acționează numai asupra fumaratului. Maleat (izomerul cis al fumaratului) nu este un substrat pentru fumarază.
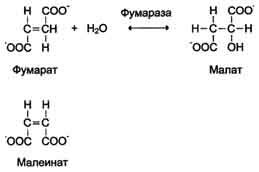
· Singurele excepții sunt enzimele epimerazei (racemase), care catalizează conversia izomerilor optici.
· Stereospecific la # 945; - și Legături de glicozidă. enzimă Amilaza acționează numai asupra legăturilor-un glicozidice, care permite amidon gidrolizotat și glicogen (polimeri de glucoză), în care sunt îmbinate resturi de glucoză # 945; - legături de glicozidă. Celuloza este, de asemenea, un polimer de glucoză, cu toate acestea, reziduurile de glucoză din ea sunt legate Legături de glicozidă. Ca urmare a lipsei de enzime umane, specifice la Legătura glicozidică, celuloza nu este hidrolizată în intestinul uman și nu poate servi drept sursă de glucoză.
· Etapele de cataliză enzimatică
· 1. Formarea substratului enzimatic
complex
Faptul că enzimele sunt foarte specifice, a permis în 1890 să prezinte o ipoteză că centrul activ al enzimei este complementar substratului, adică îi corespunde ca o "cheie de blocare". După interacțiunea substratului ("cheie") cu centrul activ ("blocare"), transformările chimice ale substratului apar în produs. Centrul activ a fost considerat o structură stabilă, rigid deterministă.
· În 1959 a fost propusă o altă versiune a ipotezei cu cheie de blocare, explicând evenimentele din centrul activ al enzimei. Conform acestei ipoteze, centrul activ este o structură flexibilă
·
· În ceea ce privește substratul. Substratul, care interacționează cu centrul activ al enzimei, determină o schimbare a conformației sale, conducând la formarea unui complex enzimă-substrat, favorabil modificărilor chimice ale substratului. În acest caz, molecula substratului își schimbă, de asemenea, conformația, care asigură o eficiență mai mare a reacției enzimatice. Această "ipoteză a corespondenței induse" a fost confirmată ulterior experimental.
· 2. Sequence of events în timpul
enzimatică cataliză
· Procesul de cataliză enzimatică poate fi împărțit condiționat în următoarele etape
· În primul rând, etapele de cataliză a doua și a patra sunt scurte și depind de concentrația substratului (pentru prima etapă) și constantele de legare a liganzilor în centrul activ al enzimei (pentru stadiile primul și al treilea). Schimbările în energia reacției chimice la aceste etape sunt nesemnificative.
· A treia etapă este cea mai lentă; durata acesteia depinde de energia de activare a reacției chimice. În această etapă, legăturile se rup în molecula substratului, formarea de noi legături și formarea moleculei produsului.
· 3. Rolul centrului activ în enzimatice
cataliză
· Ca urmare a cercetării sa demonstrat că molecula de enzimă este, de regulă, de multe ori mai mare decât molecula substratului supus unei conversii chimice de către această enzimă. Doar o mică parte din molecula enzimatică intră în contact cu substratul, de obicei 5 până la 10 reziduuri de aminoacizi care formează centrul activ al enzimei. Rolul resturilor de aminoacizi rămase este de a asigura conformarea corectă a moleculei enzimei pentru cursul optim al reacției chimice.
· Locul activ în toate etapele de cataliză enzimatică nu poate fi considerat un sit pasiv pentru legarea substratului. Aceasta este o "mașină" moleculară complexă, folosind o varietate de mecanisme chimice care facilitează transformarea substratului într-un produs.
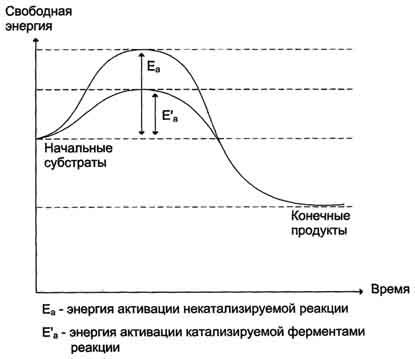
· În centrul activ al enzimei, substraturile sunt aranjate astfel încât grupurile funcționale de substraturi implicate în reacție să fie în imediata apropiere a celeilalte. Această proprietate a centrului activ se numește efect de abordare și orientare a reactivilor. Un astfel de aranjament ordonat al substraturilor determină o scădere a entropiei și, ca o consecință, o scădere a energiei de activare (Ea), care determină eficiența catalitică a enzimelor.
Centrul activ al enzimei contribuie, de asemenea, la destabilizarea legăturilor interatomice în molecula substratului, ceea ce facilitează reacția chimică și formarea de produse. Această proprietate a centrului activ se numește efectul deformării substratului.
23. concepția de holoenzimă, apoenzima, cofactor, substrat, produs de reacție, inhibitor, activator.
1. Grupurile protetice sunt puternic legate de proteine și pot fi chiar atașate prin legături covalente. Adesea joacă un rol important în funcționarea enzimelor. Proteina fără grupare prostetică numită „apoproteina“ și o proteină având atașat un grup - „holobelok“ (sau, respectiv, în cazul enzimelor - apoenzimei și holoenzimă).
Un exemplu este gemul, care este un grup protetic în moleculă de hemoglobină.
2. Cofactor-substanță non-proteină, care trebuie să fie în mod necesar prezentă în organism în cantități mici, astfel încât enzimele corespunzătoare să își poată îndeplini funcțiile. Compoziția cofactorului include coenzime și ioni metalici (de exemplu, ioni de sodiu și potasiu).
3. substrat-substanță, care suferă transformare sub acțiunea unei enzime;
4. Inhibitor enzimatic - o substanță care încetinește cursul reacției enzimatice. Există inhibitori reversibili și ireversibili. Studiul inhibiției enzimelor joacă un rol important în dezvoltarea medicamentelor, în studiul mecanismului de acțiune și structură a enzimelor.
Trimiteți-le prietenilor: