Legătura ionică și metalică. Cristale ionice și metalice
Legătura ionică este realizată prin atragerea electrostatică dintre ionii încărcați opuși. Acești ioni se formează ca rezultat al tranziției electronilor de la un atom la altul. Legătura ionică este formată între atomi care au diferențe mari în electronegativități (de obicei mai mari de 1,7 pe scara Pauling), de exemplu, între atomii de metale alcaline și halogeni.
Să luăm în considerare apariția unei legături ionice prin exemplul formării NaCI.
Din formulele electronice ale atomilor
Na 1s 2 2s 2 2p 6 3s 1 și
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
este clar că pentru a completa nivelul extern, este mai ușor pentru un atom de sodiu să dea un electron decât să atașeze șapte și este mai ușor să atașezi un atom de clor la un atom decât să dai șapte. În reacțiile chimice, atomul de sodiu dă un electron, iar atomul de clor îl ia. Ca urmare, cojile electronice ale atomilor de sodiu și clor sunt transformate în curenți electronici stabili de gaze nobile (configurația electronică a cationului de sodiu
Na + 1s 2 2s 2 2p 6.
și configurația electronică a anionului clor
Cl - - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6).
Interacțiunea electrostatică a ionilor conduce la formarea unei molecule de NaCl.
Natura legăturii chimice se reflectă adesea în starea agregată și în proprietățile fizice ale substanței. Astfel de compuși ionici ca clorura de sodiu NaCI sunt solizi și refractari deoarece există forțe puternice de atracție electrostatică între încărcăturile ionilor lor "+" și "-".
Un ion clor încărcat negativ atrage nu numai propriul ion Na +, ci și alți ioni de sodiu în jurul său. Aceasta conduce la faptul că în apropierea oricărui ion nu există un ion cu semnul opus, ci mai multe.
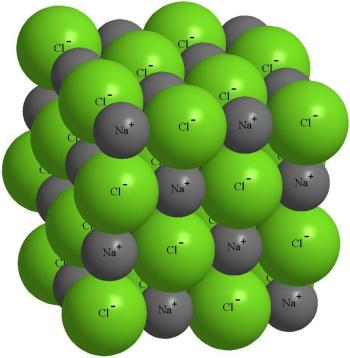
Structura cristalină a sării cu NaCI.
De fapt, aproximativ 6 ioni de sodiu sunt localizați în apropierea fiecărui ion de clor și aproximativ 6 ioni de clor în apropierea fiecărui ion de sodiu. O astfel de ambalare ordonată de ioni se numește un cristal ionic. Dacă în cristal este identificat un atom de clor separat, atunci între atomii de sodiu înconjurători este deja imposibil să găsești unul cu care clorul a reacționat.
Atrase unul de altul prin forțe electrostatice, ionii sunt extrem de reticenți în a-și schimba locația sub influența forței externe sau a creșterii temperaturii. Dar dacă clorura de sodiu este topită și continuă să se încălzească într-un vid, se evaporă, formând molecule diatomice de NaCl. Acest lucru sugerează că forțele de legare covalentă nu sunt niciodată complet oprite.
Principalele caracteristici ale legăturii ionice și ale proprietăților compușilor ionici
1. Legarea ionică este o legătură chimică puternică. Energia acestei legături este de ordinul a 300-700 kJ / mol.
2. Spre deosebire de legătura covalentă, legătura ionică nu este direcțională, deoarece ionul poate atrage ioni de semn opus în sine în orice direcție.
3. Spre deosebire de legătura covalentă, legătura ionică este nesaturată, deoarece interacțiunea dintre ionii semnalului opus nu duce la o compensare reciprocă completă a câmpurilor de forță.
4. În procesul de formare a moleculelor cu o legătură ionică, nu există un transfer complet al electronilor, astfel încât în natură nu există o sută de legături ionice. În molecula de NaCl, legătura chimică este de numai 80% ionică.
5. Compușii cu o legătură ionică sunt substanțe cristaline solide având puncte ridicate de topire și fierbere.
6. Majoritatea compușilor ionici se dizolvă în apă. Soluțiile și topiturile compușilor ionici conduc curentul electric.
Cristalele metalice sunt aranjate diferit. Dacă luăm în considerare o bucată de sodiu metalic, se va descoperi că în afară este foarte diferită de sarea de masă. Sodiul este un metal moale, ușor de tăiat cu un cuțit, aplatizat cu un ciocan, poate fi topit fără dificultate într-o ceașcă pe o lampă de spiritis (punct de topire 97,8 ° C). Într-un cristal de sodiu, fiecare atom este înconjurat de opt alți atomi asemănători.
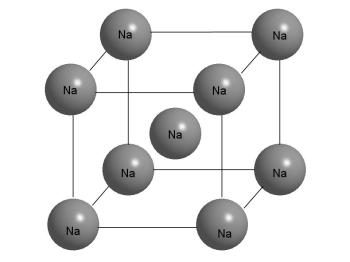
Structura cristalină a metalului Na.
Se poate observa din figura că atomul Na din centrul cubului are 8 vecini apropiați. Dar acest lucru se poate spune și pentru orice alt atom din cristal, deoarece acestea sunt la fel. Cristalul constă din fragmentele repetate "infinit" repetate, reprezentate în această figură.
Atomii metalelor la nivelul energiei externe conțin un număr mic de electroni de valență. Deoarece energia de ionizare a atomilor de metal este mică, electronii de valență sunt reținute cu puțin în acești atomi. Ca rezultat, ionii încărcați pozitiv și electronii liberi apar în rețeaua cristalină a metalelor. În acest caz, cationii metalici sunt localizați în nodurile rețelei de cristal, iar electronii se mișcă liber în câmpul centrelor pozitive care formează așa-numitul "gaz electron".
Prezența între cele două cationi a unui electron încărcat negativ conduce la faptul că fiecare cation interacționează cu acest electron.
Astfel, o legătură metalică este o legătură între ionii pozitivi din cristalele metalice, care se realizează prin atragerea electronilor care se deplasează liber prin cristal.
Deoarece electronii de valență din metal sunt distribuite uniform pe întregul cristal, legătura metalică, ca și legătura ionică, este o legătură unidirecțională. Spre deosebire de legătura covalentă, legătura metalică este o legătură nesaturată. Din legătura covalentă, legătura metalică se deosebește de puterea sa. Energia legăturii metalice este de aproximativ trei până la patru ori mai mică decât energia legăturii covalente.
Datorită mobilității ridicate a gazului de electroni, metalele sunt caracterizate de o conductivitate electrică și termică ridicată.
Un cristal metalic arata destul de simplu, dar, de fapt, dispozitivul sau electronic este mult mai complex decat cel al cristalelor de sare ionic. Nu există destule electroni pe carcasa electronică exterioară a elementelor metalice pentru a forma o legătură covalentă sau ionică plină "octet". Prin urmare, în starea gazoasă, majoritatea metalelor constau din molecule monatomice (adică atomi separați, independenți). Un exemplu tipic este vaporii de mercur. Astfel, legătura metalică dintre atomii de metal are loc numai în stare agregată lichidă și solidă.
Legătura metalică poate fi descrisă după cum urmează: o parte din atomii de metal din cristalul rezultat dă electronii lor de valență (în sodiu este 3s1) la spațiul dintre atomi, transformându-se în ioni. Deoarece toți atomii de metal din cristal sunt aceiași, fiecare dintre ei are șanse egale de a pierde electronul de valență.
Cu alte cuvinte, trecerea electronilor între atomii de metal neutri și ionizați are loc fără consumul de energie. Unii dintre electroni sunt întotdeauna în spațiul dintre atomi sub forma unui "gaz de electroni".
Acești electroni liberi, în primul rând, păstrează atomii de metal la o anumită distanță de echilibru unul față de celălalt.
În al doilea rând, ele dau metalelor o caracteristică "strălucire metalică" (electronii liberi pot interacționa cu quanta luminii).
În al treilea rând, electronii liberi asigură o conductivitate electrică bună pentru metale. Conductibilitatea termică ridicată a metalelor se explică și prin prezența electronilor liberi în spațiul interatomic - ei "răspund" cu ușurință la schimbările de energie și contribuie la transferul rapid în cristal.
Un model simplificat al structurii electronice a unui cristal metalic.
** ** ** ** Pe baza unui metal de sodiu, luăm în considerare natura legăturii metalice din punctul de vedere al conceptelor de orbitali atomici. Atomul de sodiu, ca multe alte metale, nu are electroni de valență, dar există orbitale libere de valență. Singurul 3s-electron de sodiu este capabil să se deplaseze la oricare din orbitele învecinate libere și aproape de energie. Pe măsură ce atomii se apropie reciproc de cristal, orbitele exterioare ale atomilor învecina se suprapun, astfel încât electronii care se transferă liber se mișcă prin cristal.
Cu toate acestea, "gazul electronic" nu este deloc dezordonat, așa cum pare. Electronii liberi dintr-un cristal metalic se află pe orbite suprapuse și, într-o oarecare măsură, sunt socializate, formând un fel de legături covalente. La elementele de saturație sodice, potasiu, rubidiu și alte metale s electronice socializate nu este suficientă, prin urmare cristalele lor sunt instabile și fuzibile. Pe măsură ce numărul de electroni de valență crește, rezistența metalelor tinde să crească.
Astfel, legătura metalică este predispusă să formeze elemente ale căror atomi pe carcasele exterioare au câțiva electroni de valență. Acești electroni de valență, care realizează legătura metalică, sunt atât de generalizați încât se pot deplasa de-a lungul întregului cristal metalic și asigură o conductivitate electrică ridicată a metalului.
Cristalul NaCl nu conduce un curent electric, deoarece nu există electroni liberi în spațiul dintre ioni. Toți electronii, dat de atomii de sodiu, țin ferm ioni de clor în jurul lor. Aceasta este una dintre diferențele esențiale dintre cristalele ionice și cele metalice.
Ceea ce știți acum despre legarea metalului face posibilă explicarea ductilității ridicate (ductilității) majorității metalelor. Metalul poate fi aplatizat într-o foaie subțire, tras într-un fir. Faptul este că straturile individuale de atomi dintr-un cristal metalic pot glisa relativ ușor unul câte unul: "gazul electronic" mobil înmoaie constant mișcarea ionilor pozitivi individuali, protejându-i unul de celălalt.
Desigur, nimic de acest gen nu poate fi făcut cu sare, deși sarea este și o substanță cristalină. În cristalele ionice, electronii de valență sunt strâns legați de nucleul atomului. Trecerea unui strat de ioni în raport cu cealaltă duce la apropierea ionilor de aceeași încărcătură și provoacă o repulsie puternică între ele, ca urmare a distrugerii cristalului (NaCl este o substanță fragilă).
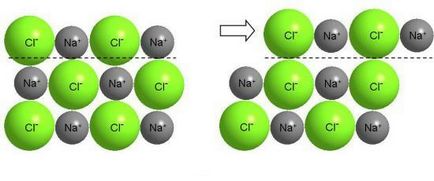
Tăierea straturilor cristalului ionic determină apariția unor forțe mari de respingere între ionii de același nume și distrugerea cristalului.
Articole similare
-
Cutie metalică și din lemn pentru siding face it yourself (video)
-
Usi metalice pentru birou, usi de intrare de fier de la firma a devenit
-
Plăcerea ușilor de fier cum să ajusteze ușile de intrare metalice cu propriile mâini, video
Trimiteți-le prietenilor: