Caracteristicile generale ale sulfului
Sulful este elementul al șaisprezecelea al mesei periodice. Denumirea este S din latina "sulf". Situat în a treia perioadă, grupul VIA. Se referă la metale nemetalice. Încărcarea nucleului este de 16.
Sulful se găsește în natură atât în stare liberă (sulf nativ), cât și în diferiți compuși. Compușii sulfului cu metale diferite sunt foarte frecvente. Multe dintre ele sunt minereuri valoroase (de exemplu, luciu de plumb PbS, Zn amestec de zinc, cupru strălucire Cu2S) și servesc ca o sursă de metale neferoase.
Dintre compușii sulfului din natură, sulfații, în principal, calciu și magneziu, sunt, de asemenea, obișnuiți. În final, compușii de sulf sunt conținute în organismele vegetale și animale.
Masa atomică și moleculară a sulfului
Masă moleculară relativă a substanței (dl) - este un număr care arată cât de multe ori mai mult 1/12 atomi de carbon în greutate masa a moleculei, și elementul relativ masa atomică (Ar) - câte ori greutatea medie a atomilor de element chimic este mai mare decât masa atomică a 1/12 carbon.
Valorile masei atomice și moleculare de sulf coincid; ele sunt egale cu 32.059.
Alotropia și modificările de sulf alotrop
Sulful există sub forma a două modificări alotrope - rombice și monoclinice.
La presiuni obișnuite, sulful formează cristale galbene fragile, topiind la 112,8 ° C; densitatea este de 2,07 g / cm3. Este insolubilă în apă, dar mai degrabă solubilă în disulfură de carbon, benzen și alte lichide. Atunci când aceste lichide se evaporă, sulful este eliberat din soluție sub formă de cristale galbene dintr-un sistem rombic având forma octaedrei, în care, de regulă, o parte din colțuri sau muchii este tăiată (figura 1). Această modificare a sulfului se numește rombică.
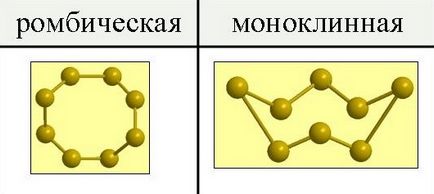
Fig. 1. Modificări alotrope ale sulfului.
Alte forme de cristale se obțin dacă sulful topit este răcit lent și, când se solidifică parțial, se scurge lichidul care nu a avut încă timp să se solidifice. În aceste condiții, pereții vasului sunt acoperite din interior prin cristale de ac în galben închis, de culoare închisă, ale sistemului monoclinic. Această modificare a sulfului se numește monoclinică. Are o densitate de 1,96 g / cm3, se topește la 119,3 ° C și este stabilă numai la o temperatură de peste 96 ° C.
Izotopi de sulf
Se știe că în natură sulful poate fi sub forma a patru izotopi stabili 32 S, 33 S, 34 S și 36 S. Numerele lor de masă sunt 32, 33, 34 și, respectiv, 36. Nucleul unui atom de sulf izotop S 32 conține șaisprezece șaisprezece protoni și neutroni și izotopul 33 S, 34 S și 36 S același număr de protoni, șaptesprezece, optsprezece și douăzeci de neutroni respectiv.
Există izotopi artificiali de sulf cu număr de masă de la 26 la 49, dintre care cel mai stabil este 35 S cu un timp de înjumătățire de 87 de zile.
La nivelul energiei externe a atomului de sulf, există șase electroni care sunt valenți:
1s 2 2s 2 2p 6 3s 2 3p 4.
Ca rezultat al interacțiunii chimice, sulful își poate pierde electronii de valență, i. E. să fie donatorul lor și să se transforme în ioni încărcați pozitiv sau să ia electronii unui alt atom, adică să fie acceptorul lor și să se transforme în ioni încărcați negativ:
S 0-6e → S 6+;
S 0 -4e → S 4+;
S 0 -4e → S 2+;
S o + 2e → S 2-.
Molecule și atom de sulf
Moleculele de sulf ale monatomului sunt S. Să dăm câteva proprietăți care caracterizează atomul și molecula de sulf:
Articole similare
Trimiteți-le prietenilor: