Mecanism de acțiune al enzimelor
În cataliza enzimatică, se manifestă natura proteică a enzimelor, termolabilitatea lor, pH-ul mediului, specificitatea acțiunii, capacitatea catalitică ridicată, sensibilitatea la activatori și inhibitori. Reacția enzimatică se desfășoară în conformitate cu legea acțiunii în masă.
Enzime și energie de activare. Enzimele sunt catalizatori biologici. Acestea afectează rata de reacție în două direcții: accelerează scindarea sau sinteza anumitor substanțe. Creșterea vitezei de reacție se datorează unei modificări a energiei de activare a moleculelor de substrat. Energia de activare E caracterizează bariera energetică, care trebuie depășită pentru a aduce substanțele reactive în stare activă. Aceasta se datorează forțelor de coeziune intermoleculară sau repulzării intermoleculare a substanțelor care reacționează. Rata de reacție poate fi crescută prin creșterea numărului de molecule activate sau prin reducerea înălțimii barierului energetic.
Moleculele de substraturi pot fi aduse în stare activă în diverse moduri. Una dintre ele este încălzirea, în care viteza de mișcare a moleculelor și posibilitatea contactului lor cresc în soluții. În prezența unui catalizator, bariera energetică și scăderea energiei de activare (culoarea tabelului IV). Astfel, pentru descompunerea zaharzei în glucoză și fructoză sub influența acidului sulfuric E = 134,400 J / mol și cu invertază, 40 420 J / mol. Pentru hidroliza cazeinei acid clorhidric
acidul E = 109 200 J / mol, pepsină - 50 400 J / mol. (. Figura 40) Energia de activare a descompunerii peroxidului de hidrogen fără catalizator este de 75 600 J / mol (E1), cu platina coloidal - 49 140 (E2), ficat catalază - 23 100 J / mol (E3).
Teoria catalizei enzimatice. Procesele de cataliză sunt explicate pe deplin de teoria lui Michaelis-Menten. Conform acestei teorii, există patru etape.
Stau eu. Între substratul (S) și enzima (E), există o conexiune - format complex enzimă-substrat al ES, în care componentele sunt interconectate prin legături covalente, ionice, hidrogen și alte legături.
Etapa a II-a. Substratul sub influența enzimei atașate este activat, devenind disponibil pentru reacțiile de cataliză corespunzătoare ale ES.
Etapa III. Se efectuează cataliza ES *.
Etapa a IV-a. Molecula enzimei E și produsele de reacție P.
Secvența transformărilor reflectă următoarea schemă:
Teoria catalizei enzimatice a fost confirmată experimental. Deci, din hrean, o enzima care desprinde peroxidul de hidrogen - peroxidaza maro. După ce enzima E este conectată la substratul H2O2 (S), apare un complex de enzime-substrat ES de culoare verde. După un timp, substratul este activat, formând un substrat activat de enzime de culoare ES * roșiatică. Se împarte în enzima maro E și produsele de dezintegrare ale P.
Centrul activ al enzimei. Particulele enzimei
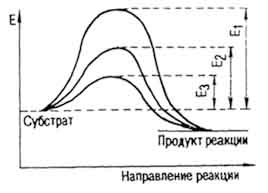
Fig. 40. Reducerea energiei de activare prin intermediul unui catalizator (conform lui E. Hoffmann)
are mari rezerve de energie liberă și se poate adsorbi pe moleculele de suprafață sau porțiuni substraturi, ale căror dimensiuni, în cele mai multe cazuri este de multe ori mai mică decât dimensiunea moleculei enzimei. În reacția de enzimă și a particulelor substratului schimbă configurația sa - având cavitate deosebită și în care se formează un complex enzimă-substrat. Această parte a moleculei enzimei se numește situsul de legare a substratului. În molecula enzimei, situsul catalitic este eliberat, locul activ. Este o enzimă grupare funcțională care se leagă în metaboliți cu greutate moleculară mică sau efectori alterează structura sa terțiară și inhibă activitatea unei enzime numite centru alosteric. Cele mai multe enzime au unul, câteva - două sau mai multe centre active. Substrat-legarea și centrele active se suprapun adesea teritorial. Moleculele de tripsină și carboxipeptidază au un centru activ, glyceraldehyde - 2, ureazei - 3-4, colinesteraza - 20-100.
Centrul activ conține grupări care realizează o interacțiune strânsă între particulele substratului și enzimă. Ei sunt capabili de a reduce cantitatea de energie de activare pentru a forma un prim complex de ES, ES * și apoi, în final, E și P. In enzime simple formarea centrului activ al proteinei implicate grupări funcționale în enzime complexe - și cofactori corespunzătoare. Reziduurile de aminoacizi care intră în centrul activ pot fi împărțite în trei tipuri. Unele dintre ele poartă grupările care acționează asupra substratului în timpul catalizei, alții fac contact între enzimă și substrat, al treilea operează rol pur structural în menținerea structurii terțiare a moleculei de enzimă. În cursul acțiunii catalitice, are loc o "adaptare" inductivă a substratului (uneori un inhibitor) la centrul activ (Figura 41).
Chimia de interacțiune a situsului activ cu substratul a fost studiată în cea mai mare măsură pentru acetilcholinesteraza (AChE). Se referă la enzimele simple. Centrul activ al moleculei sale (figura 42, A) conține cel puțin patru resturi de aminoacizi: serină, histidină, tirozină și acid glutamic. La etapa I
Fig. 41. Schema de "potrivire" indusă a enzimei și a substratului, enzimă și inhibitor) conform DB Moss, LJ Watterworth)
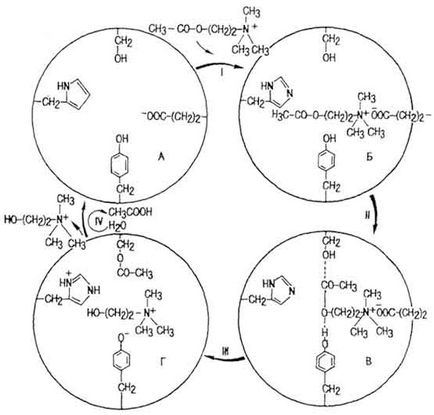
Fig. 42. Mecanismul de acțiune al colinesterazei (conform lui Yu B. Filippovich)
AChE atunci când interacționează cu complexul neuronale excitație mediator acetilcolina (AX) enzima are loc - AX (Figura 42, B.). În etapa a II-complex este activat prin interacțiunea serina și tirozină reziduuri ale centrului activ al moleculei și AX (fig. 42 B). Bariera energetică scade (apare ES *). La etapa III sub influența radicalul histidinei tras de protoni din gruparea hidroxil a tirozinei, formând o legătură esterică între restul serină și o grupare AX acetil, rupe legătura între restul de acid acetic și reziduul de colină (Fig. 42, L. La etapa IV este ES hidrolizată * -complexul. recuperarea centrului activ al acetilcolinesterazei, colina distins și acid acetic. Hidroliza AX are loc la viteză mare. Astfel, o porțiune din AX 1-2 ug distruse 0, 1-0, 2 ms.
Kinetica reacțiilor enzimatice. Fiecare reacție chimică are loc cu o anumită rată. Scopul biologic al enzimelor este o creștere directă a ratei reacțiilor chimice. Aceste procese sunt studiate prin cinetica enzimatică.
cineticile enzimatice - secțiunea chimică Kinetics, studiază dependența vitezei reacțiilor enzimatice la natura chimică a reactanților (substraturi, enzime) și condițiile de interacțiunea lor (concentrația componentelor, pH, compoziția medie, temperatura, activatori de acțiune sau inhibitori, și altele.). Dispozițiile sale permit evaluarea proceselor enzimatice și influențarea direcției lor de curgere. Să trăim pe principalele.
Există mai multe tipuri de reacții enzimatice .. reacție Irreversible cu un substrat, reacția reversibilă cu un substrat, reacția ireversibil cu cele două substraturi, etc. Cea mai frecventă reacție ireversibilă cu un substrat.
În cel de-al doilea caz, enzima E reacționează mai întâi cu substratul S, ceea ce duce la formarea unui complex enzimatic-substrat ES (în multe reacții, două sau mai multe complexe). Complexul enzimă-substrat este caracterizat prin constanta de viteză a reacției de formare a lui k + 1 și a constantei de viteză a degradării k-1.
Un complex enzimă-substrat este caracterizat de o constantă a substratului sau de constanta de disociere Ks.
Valoarea constantei substratului depinde de natura substratului și a enzimei. La concentrațiile inițiale identice ale enzimei și substratului, concentrația complexului [ES] va fi cea mai mare, cu atât este mai mică valoarea lui Ks.
Constanta substratului determină gradul de afinitate al enzimei și substratului. Deci, pentru invertaza Ks = 0,0167. Aici concentrația complexului enzimă-substrat depășește concentrația enzimei libere și a substratului cu aproximativ 60 de ori.
În a doua fază a catalizei enzimatice, complexul enzimă-substrat se descompune în enzima E și produsul de reacție P.
Ambele faze ale catalizei enzimatice sunt combinate într-un sistem tipic pentru reacțiile ireversibile cu un singur substrat:
În sistem, k + 2 este constanta vitezei pentru descompunerea complexului enzimă-substrat în enzime și produsul de reacție P.
Pentru a caracteriza complet procesul enzimatic, se folosește Km constant Km. Acesta exprimă raportul dintre constantele celor trei reacții prezentate în sistem
Expresia numerică pentru Km este întotdeauna ceva mai mare decât Ks. Astfel, valoarea Ks pentru complexul de zaharoză-sucroză enzime-substrat este 0,0167, iar valoarea lui Km este de 0,0280 mol / l. Km pentru diferite enzime nu este același.
Rata reacțiilor enzimatice este exprimată în catal (pisică). Catal este activitatea catalitică a enzimei, capabilă să realizeze reacția la o viteză de 1 mol / s într-un sistem dat pentru măsurarea activității. derivați de Catala -mikrokatali sunt adesea folosite (MAB), nanokatali (nkat) sau pikokatali (pkat), ceea ce corespunde vitezei reacțiilor exprimate în micromoli și picomoli nanomoli pe secundă.
Rata reacției enzimatice este determinată de condițiile din cursul ei. De exemplu, în condiții optime (saturația completă a substratului enzimatic, pH-ul dorit, temperatura de 25 ° C sau 37), acesta va fi maximul sau inițiala, și este notat cu V. O astfel de rată se caracterizează printr-o rată de descreștere constantă a concentrației complexe și enzimă-enzimă substrat:
Pentru reacția enzimatică, care apare atunci când enzima nu este suficient de saturată cu un substrat, rata observată # 957; Se determină prin produsul constantei vitezei de descompunere a complexului enzimă-substrat cu formarea produsului de reacție P și concentrația complexului enzimă-substrat:
Dacă luăm în considerare acest lucru
Astfel, viteza reacției enzimatice este direct proporțională cu constanta vitezei de descompunere a complexului enzimă-substrat cu formarea produsului de reacție, concentrația enzimei, substratului și invers proporțională cu constanta substratului.
Pentru stadiul staționar al reacției, concentrația [ES] este constantă. Dacă [S]> [E], atunci
Aplicând constanta Michaelis, putem simplifica ecuația:
Rata de reacție observată poate fi exprimată prin ecuație
Prin creșterea concentrației substratului [S], unde [S]> Km.
Aici, rata reacției enzimatice tinde la un maxim. Rata de reacție poate fi caracterizată prin ecuația lui Michaelis-Menten:
Rezultă din ecuația că, pentru o concentrație nesemnificativă a substratului, viteza reacției enzimatice depinde liniar de [S] și la o concentrație foarte mare a substratului, tinde la viteza maximă Vm și nu se modifică odată cu creșterea [S]. De asemenea, ecuația arată că, dacă
nivelul [S]> [E], viteza de reacție este proporțională cu concentrația enzimei E.
Articole similare
Trimiteți-le prietenilor: