ENERGIA ACTIVITATII in r-tiunile elementare, min. energia reactivilor (atomi de molecule și alte particule), suficiente pentru a intra în compoziția chimică. p-TION, t. e. a depăși bariera în dressing-IFPS de energie potențială care separă reactanții de produse p-TION. O barieră potențială este maximul energiei potențiale prin care sistemul trebuie să treacă prin actul elementar al chimiei. transformare. Înălțimea barierei potențial pentru orice cale care trece printr-o stare de tranziție, egală cu energia potențială în starea de tranziție. În cazul în care complexul p-TION constând din elementari p-tiile seriale și paralele, nu există limitare elementară p-TION (p-TION cu max. Timp caracteristic), este energia de activare și energia de activare a complexului p-TION. În macroscopic. Chem. cinetica, energia energetică de activare. parametrul Ea. Ecuația care intră în Arrhenius: unde k este rata constantă; A este un factor pre-exponențial (o constantă sau o cantitate care depinde foarte puțin de cantitate); k este constanta Boltzmann; T - abs. temp. Grafic lnk 1 / kT (graficul Arrhenius) - linie dreaptă. Energia de activare observată este calculată de la tangenta pantei acestei linii. În general, complex parametrul p-tiile în Equ Ea Arrhenius-SRI p-TION este energia de activare a etapelor individuale și a energiei de activare determinată se numește. eficace (empiric, aparent).
Orice proces, însoțit de. schimbarea energiei, este exotermă într-o direcție și endotermă în cealaltă. Energia de activare este exotermă. și endotermă. direcțiile p-tion, desemnate respectiv. și, sunt legate de relația:
unde Q este căldura p-tiunii la T = 0. Geom calitativ unidimensional. o ilustrare a legăturii dintre energia de activare și înălțimea barierului potențial și căldura de pătrundere este prezentată în Fig. unde q este coordonatul reacției (a se vedea și teoria complexului activat); E1 și E2 - respectiv nivelurile de energie. starea de bază a reactivilor și a produselor p-tion.
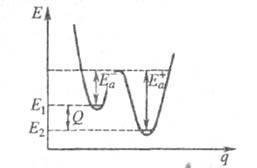
Pentru recombinare p-ti free. radicali (inclusiv atomi), precum și pentru o clasă exotermă largă. reacțiile moleculare ionice, energia de activare este zero sau foarte mică în comparație cu valorile tipice ale energiei chimice. a legăturilor Esb. Pentru p-tion, însoțită de ruptura simultană a unora și formarea altor agenți chimici. legături, este, de obicei, de la câteva sute la o zecime din o parte din Esb. dacă printre reactivi există o cantitate liberă. radicali și este comparabil cu Eq. dacă reactivii sunt molecule saturate chimic. m. b. anormal de mare (de exemplu, mai mare decât energia de excitație a atomului E *) în excesele de stingere a excitației electronice în coliziuni de atomi. A * + A A + A dacă punctul de intersecție al termenilor reactivilor și al produselor p-tion este ridicat comparativ cu E * sau termenii nu se intersectează.
Empirical este cunoscut. corelații, stabilind o relație aproximativă între Ea și Q pentru p-tions similare, de exemplu, regula Polanyi-Semyonov:
unde E0 și u sunt constante. Teoretic. Calculele Ea se fac prin metode aproximative de chimie cuantică. Exact secvențial erori mecanice cuantice. au fost realizate până acum calcule pentru sisteme care nu conțin mai mult de 3 electroni. de ex. pentru 3 atomi de hidrogen.
Pentru a imprima energia de activare necesară sistemului, se utilizează încălzirea, efectul radiației electromagnetice etc. și catalizatorii. ghiduri chimice. p-tion pe o cale cu o energie de activare inferioară.

Articole similare
Trimiteți-le prietenilor: