Raportați student 10 cl. "B"
Elena Masolova pe tema:
Electroliza este un proces de reducere a oxidării care are loc pe electrozi atunci când un curent electric direct trece printr-o soluție sau topitură de electroliți.
Pentru a efectua electroliza, un catod este conectat la polul negativ al sursei cc externe. și anodul la polul pozitiv. după care acestea sunt scufundate într-un electrolizor cu o soluție sau o topire a electrolitului.
Electrozii, de regulă, sunt metalici, dar și nemetalici, de exemplu grafitul (curentul conductiv).
Pe suprafața electrodului conectat la polul negativ al sursei DC (catod), ionii, moleculele sau atomii atașează electroni, adică se produce o reacție de reducere electrochimică. Electrodul pozitiv (anodul) este reculul electronilor, adică reacția de oxidare. Astfel, esența electrolizei este că procesul de reducere are loc pe catod și procesul de oxidare la anod.
Ca rezultat al electroliza la electrozii (catod și anod) sunt alocate corespunzător reducerii și de oxidare, care, în funcție de condițiile pot reacționa cu solventul, materialul de electrod etc. - .. Așa-numitele procese secundare.
Anodii metalici pot fi: a) insolubili sau inerți (Pt, Au, Ir, grafit sau cărbune, etc.); în timpul electrolizei ele servesc doar ca transmițătoare electronice; b) solubil (activ); în timpul electrolizei, ele sunt oxidate.
În soluții și topiri de diferite electroliți există ioni cu semn opus, adică cationi și anioni. care se află într-o mișcare haotică. Dar dacă într-o astfel de topitură de electroliți, de exemplu o topitură de clorură de sodiu NaCI, coborâți electrozii și treceți un curent electric constant, cationii Na + se vor deplasa la catod și anionii Cl - - la anod. La catodul celulei are loc procesul de reducere a cationilor Na + prin electroni ai unei surse de curent externa:
La anod, există un proces de oxidare a anionilor clorului, iar separarea excesului de electroni de Cl - se datorează energiei sursei externe de curent:
Atomii clorului care evoluează din punct de vedere electric neutru se combină pentru a forma clorul molecular: Cl + Cl = Cl2. care este eliberat la anod.
Ecuația totală de electroliză a topiturii de clorură de sodiu:
2NaCl -> 2Na + + 2Cl - - electroliza -> 2Na + + Cl2O
Acțiunea de reducere oxidativă a unui curent electric poate fi de multe ori mai puternică decât cea a oxidanților chimici și a agenților reducători. Prin schimbarea tensiunii pe electrozi, aproape orice forță poate fi generată de agenți de oxidare și de agenți reducători, care sunt electrozi ai unei băi electrolitice sau a unei celule electrolitice.
Se știe că nici unul dintre cei mai puternici oxidanți chimici nu poate îndepărta de ionul de fluor F-electronul său. Dar acest lucru este posibil pentru electroliză, de exemplu, topiți sare NaF. În acest caz, sodiul sau calciul metalic sunt eliberate din starea ionică pe catod (agent reducător):
Fluxul de ioni F - este eliberat la anod (oxidant). trecerea de la un ion negativ la o stare liberă:
F - - e - = F 0; F 0 + F 0 = F 2 0
-Produsele emise pe electrozi pot intra în interacțiunea chimică între ele, astfel încât spațiul anodic și catodic este separat de o diafragmă.
Aplicarea practică a electrolizei.
procesele electrochimice sunt utilizate pe scară largă în diferite domenii ale tehnicilor moderne în chimia analitică, biochimie și altele asemenea. D. In industria electrolizei preparate clor și fluor chimic, alcaline, clorați și perclorați, acidul persulfuric și persulfați, chimic hidrogen și oxigen pur, și așa mai departe. D. Astfel, o singură substanță obținută prin reducerea la catod (aldehide, para-aminofenol, etc.), altele electrooxidation la anod (clorați, perclorati, permanganat de potasiu, etc.).
Electroliza în hidrometalurgie este una din etapele de prelucrare a materiilor prime care conțin metal, asigurând producerea de metale comerciale.
Electroliza poate fi efectuată cu anozi solubili - procesul de electro-rafinare sau cu insolubile - procesul de electroextracție.
Sarcina principală în electrorefinarea metalelor este de a asigura puritatea necesară a catodului metalic la costuri acceptabile de energie.
În metalurgia neferoasă, electroliza este utilizată pentru a extrage metalele din minereuri și pentru a le purifica. Electroliza mediilor topite produce aluminiu, magneziu, titan, zirconiu, uraniu, beriliu etc.
Pentru rafinarea (curățarea) metalului prin electroliză, plăcile sunt turnate din acesta și așezate ca anozi într-un electrolizer. Când curentul este trecut, metalul care urmează să fie purificat este supus unei dizolvări anodice, adică trece în soluție sub formă de cationi. Apoi, acești cationi metalici sunt evacuați la catod, prin care se formează un precipitat compact de metal deja pur. Impuritățile din anod rămân insolubile sau se duc în electrolit și sunt îndepărtate.
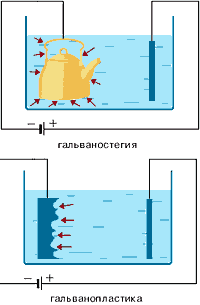
Galvanotehnica este un domeniu de electrochimie aplicată care se ocupă cu procesele de aplicare a acoperirilor metalice pe suprafața produselor atât metalice cât și nemetalice atunci când trec un curent electric constant prin soluții ale sărurilor lor. Galvanizarea poate fi împărțită prin galvanizare și electroformare.
¨ Galvanica (din capacul grecesc.) - este electrodepuse pe suprafața metalică a unui alt metal, care se leagă în mod ferm (este cuplată) cu metalul de acoperire (subiect), care servește drept catod celulei.
Produsele trebuie să fie bine curățați suprafața înainte de acoperire (degresa și etch), în caz contrar metalul este depozitat neuniform, iar în plus, adeziunea (legătură) cu acoperirea de suprafață a articolelor din metal este instabilă. Metoda de galvanizare poate acoperi partea cu un strat subțire de aur sau argint, crom sau nichel. Cu ajutorul electrolizei, este posibil să se aplice cele mai fine straturi de metal pe diferite suprafețe metalice. În această metodă de acoperire, partea este utilizată ca un catod plasat într-o soluție a sării metalice a metalului a cărui acoperire urmează a fi obținută. Un anod al aceluiași metal este folosit ca anodul.
¨ Electroliza - producerea prin electroliză a unor copii metalice precise și ușor detașabile, de grosime relativ mare, din diferite obiecte nemetalice și metalice numite matrice.
Cu ajutorul busturilor de fabricare a electrotype, statui etc.
Galvanizarea este folosită pentru a aplica învelișuri metalice relativ groase la alte metale (de exemplu, formarea unui strat "deasupra capului" de nichel, argint, aur etc.).
În plus față de cele de mai sus, electroliza a fost găsită în alte domenii:
-obținerea de filme protectoare de oxid pe metale (anodizare);
-tratarea electrochimică a suprafețelor produselor metalice (lustruire);
-colorarea electrochimică a metalelor (de exemplu, cupru, alamă, zinc, crom etc.);
-Purificarea apei - îndepărtarea impurităților solubile din acesta. Rezultatul este așa-numita apă moale (care, prin proprietățile sale, se apropie de apa distilată);
-ascuțirea electrochimică a uneltelor de tăiere (de exemplu, cuțite chirurgicale, mașini de ras, etc.).
Multumesc, am ajutat! Luați o pauză, student, aici ați avut o bună dispoziție: Profesor la examen: Mai devreme, în tinerețe, eram furios - am umplut studenții numai în felul acesta, dar acum am devenit vechi, potrivite. ia o carte de carte a unui student, vino să te reia. Apropo, un anecdot este luat de chatanekdotov.ru
Articole similare
Trimiteți-le prietenilor: