O legătură covalentă este o legătură între doi atomi care sunt conectați unul la altul prin formarea unei perechi electronice GENERALE.
Există două mecanisme posibile pentru formarea unei perechi de electroni comune:
· Mecanismul de schimb, atunci când fiecare dintre atomii interacțioși furnizează un electron per pereche,
· Mecanism donator-acceptor. dacă unul dintre atomi furnizează o pereche electronică, iar celălalt - un orbital gol (vacant).
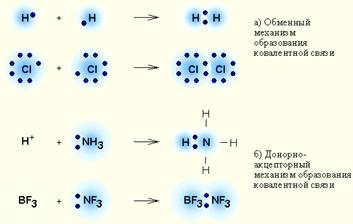
# 8252; în conformitate cu mecanismul donor-acceptor, legăturile se formează în următoarele substanțe:
1. Toți compușii complexi;
4. Gaze CO - monoxid de carbon, O3 - ozon.
Electronegativitatea (EO) - capacitatea unui atom de a atrage electroni în formarea unei legături chimice. Astfel, electronul va trece la atomul acelui element, care are o electronegativitate mare.
Probabil trei cazuri pentru doi atomi A și B, care formează o legătură: AB
1) EO (A) = EO (B) (diferența dintre electronegativități este zero).
Perechea comună de electroni nu este deplasată la nici unul dintre atomi. Stâlpii nu apar, densitatea electronilor pentru ambii atomi este aceeași.
Aceasta este o robie nepolară.
# 8252; Exemple de legături covalente nepolare sunt: a) substanțe simple diatomice. H-H, F-F,
b) moleculele simetrice de tipul H2O2 (H-O-O-H) - legătura dintre doi atomi de oxigen, etc.
Atunci când se formează o legătură covalentă, perechea de electroni este mutată la atomul mai electronegativ A. O sarcină negativă parțială apare pe ea și o sarcină parțială pozitivă pe B.
Această conexiune se numește polar covalent.
# 8252; Acest tip de legătura este caracteristică moleculelor (sau părților moleculare) constând din două sau mai multe nemetale (HCI, H20, CH3COOH).
Cu cât este mai mare diferența în EO, cu atât este mai mare polaritatea legăturii (în acest caz, perechea de electroni aparține ambilor atomi). De exemplu, în seria HCI à HBr à HI polaritatea conexiunii scade.
3) EO (A) >> EO (B).
Diferența electronegativităților este atât de mare încât atomul B (metalul) dă electronul său la atomul B (nemetal). Există ION-cation B + și anion A-.
O astfel de conexiune se numește ION.
Legătura ionică este cazul limitativ al unei legături covalente polar.
# 8252; Acest tip de legătură este caracteristic compușilor metalici cu metale, oxizi de metale, baze și săruri, inclusiv săruri organice și săruri de amoniu.
Nu există molecule în cristalul ionic. Fiecare ion este înconjurat de un anumit număr de ioni de alt semn.
Legătura ionică este caracterizată prin non-directivitate și nesaturare. Substanțele cu o legătură ionică au o latură de cristal ionic.
# 8252; trebuie reamintit faptul că există substanțe din moleculă care sunt prezente simultan și legăturile ionice și covalente (de exemplu, NaOH, KNO3).
3. O legătură metalică are loc în substanțe simple - metalele dintre ionii metalici încărcați pozitiv și electronii în mișcare liberă ("electron gas"). Prezența unei astfel de mișcări libere a electronilor determină o bună căldură și o conductivitate electrică a metalelor.
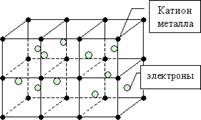
Atomii metalelor diferă de atomii altor elemente prin faptul că își păstrează relativ slab electronii externi. Prin urmare, acești electroni își părăsesc atomii, transformându-i în ioni încărcați pozitiv. Electronii "generici" se deplasează în spațiul dintre cationii metalici și îi mențin împreună.
O legătură de hidrogen este o legătură nu în interiorul unei molecule, ci între molecule sau între părți independente ale moleculelor.
Legătura cu hidrogen - are loc între atomii puternic electronegativi (de obicei hidrogen sau fluor, mai puțin adesea azot) și atomul de hidrogen dintr-o altă moleculă sau parte a moleculei:
(linia solidă denotă o legătură covalentă, punctele - legătură hidrogen).
Prezența legăturilor de hidrogen conduce la o creștere anormală a punctelor de fierbere ale substanțelor în care este prezentă.
Punctele de fierbere ale compușilor hidrogen din grupa nonmetal din grupa VI
Gradul de oxidare - taxa ipotetic pe un atom într-o moleculă, calculată pe baza ipotezei caracterului ionic al obligațiunilor și de faptul că întreaga moleculă este neutră din punct de vedere electric.
Lungimea, energia (rezistența) și polaritatea legăturii.
Lungimea legăturii este distanța dintre nucleele atomilor din compus.
A) de la razele atomilor care formează legătura
B) privind multiplicitatea conexiunii (single, double, triple).
De obicei, cu cât lungimea conexiunii este mai lungă, cu atât este mai mică energia (puterea).
Comunicarea este considerată a fi puternic dacă energia depășește 500 kJ / mol (de exemplu, 942 kJ / mol pentru N2), slab - în cazul în care energia este mai mică de 100 kJ / mol (de exemplu, 69 kJ / mol până la NO2).
Dacă atomul este legat la alți atomi prin legături identice, dar formarea lor implică diferite tipuri de orbitali, este folosit prin hibridizare.
Exemplu: molecula CH4 are forma unui tetraedru regulat în toate conexiune 4 au aceeași lungime, rezistență, sunt la unghiuri egale între ele.
Cu toate acestea, pentru un atom de carbon tetravalent, electronii sunt localizați pe trei p-orbitale și un s-orbitale. Ele sunt diferite în ceea ce privește energia, forma și sunt situate diferit în spațiu.
Pentru explicație, se folosește conceptul de HYBRIDIZATION:
din patru orbite atomice se formează 4 noi,
hibride orbitale, care în spațiu sunt situate la distanța maximă unul față de celălalt. Acesta este un tetraedru obișnuit, unghiurile dintre legături sunt 109 ° 29 '.
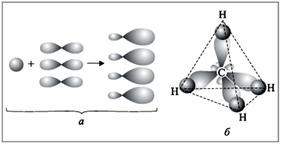
Deoarece formarea a patru legături implică o s și trei p-shell-uri, acest tip de hibridizare este notat cu sp3
În funcție de numărul și tipul orbitalilor care participă la hibridizare, se disting următoarele tipuri de hibridizare:
1) hibridizarea sp. Se utilizează un s-orbital și un p-orbital. Molecula are o structură liniară, unghiul de valență este de 1800.
2) sp2-hibridizare. Au participat un s-orbital și două p-orbitale. Molecula este localizată în plan (capetele orbitalilor hibrizi sunt direcționați spre vârfurile unui triunghi echilateral), unghiul de valență este de 1200.
3) hibridizarea sp3. Sunt implicați un s-orbital și trei p-orbitale. Molecula are o formă tetraedrică, unghiul de valență este 109.280.
4) hibridizarea sp3d. Forma moleculei este BIPIRAMIDE trigonal.
5) hibridizarea sp3d2, de exemplu SF6. Forma moleculei este OCTAAEDR.
Cum se determină tipul de hibridizare?
1. Legăturile Sigma și ION COELS UNIQUE participă la hibridizare.
2. Numărul total al orbitalilor participanți - determină tipul de hibridizare.
Sarcina: determinarea tipului de hibridizare a unui atom de carbon într-o moleculă de fosgen.
1) 2 formează un legături simple carbon (care obligațiuni sigma) și o dublă legătură (sigma + pi) .Toate 4 electroni carbon implicat în formarea acestor legături.
2) astfel, conexiunile THIRD SIGMA vor lua parte la hibridizare. Aceasta este sp2-hibridizarea. molecula are forma unui triunghi plat. Legătura P este perpendiculară pe planul acestui triunghi.
Controlează întrebări pe tema structurii materiei.
1. Care sunt mecanismele de formare a legăturii covalente? Ce conexiune numim covalent?
2. Care este diferența dintre o legătură ionică și o legătură covalentă?
3. Care este valența? Cum este determinată valența atomilor?
4. Ce atomi nu au cea mai mare valență egală cu numărul grupului?
5. Polaritatea comunicării - care sunt factorii care o determină?
6. Care substanță are cel mai înalt grad de ionicitate?
7. Ce este o legătură metalică?
8. Care sunt proprietățile metalelor asociate tipului de legătură metalic?
9. Când apare o legătură de hidrogen? Cum afectează proprietățile fizice ale substanțelor?
10. Ce factori determină rezistența și lungimea conexiunii?
11. Conexiuni Sigma și pi. Diferențe și caracteristici.
12. Tipuri de hibridizare a orbitalilor în substanțe organice și anorganice. Forma moleculelor cu diferite tipuri de hibridizare.
13. Tipuri de laturi cristaline. Caracteristicile laturilor de diferite tipuri: rezistență, proprietăți fizice.
14. Legătura donator-acceptor - trăsăturile educației, substanțele în care este prezentă.
Articole similare
-
Semnalizarea cu feedback și planta auto la ochi - 24 septembrie 2018 - site-ul ochiului mașinii mele
Trimiteți-le prietenilor: