Potențiale de electrozi
În OVR, transferul de electroni prin reducerea agenților la oxidanți are loc atunci când particulele sunt direct contactate și energia reacției chimice trece în căldură. Energia oricărui IAD. care curge în soluția de electroliți. pot fi transformate în energie electrică. De exemplu, dacă procesele de oxidare-reducere sunt separate spațial, adică transferul de electroni de către reductor va avea loc prin conductorul de electricitate. Aceasta se realizează în celule galvanice, unde energia electrică este obținută din energia chimică a reacției de oxidare-reducere.
Luați în considerare elementul galvanic al lui Daniel-Jacobi. în care vasul stâng este umplut cu o soluție de sulfat de zinc ZnS04. cu placa de zinc coborâtă în ea, iar vasul din dreapta - cu soluție de sulfat de cupru CuSO4. cu o placă de cupru coborâtă în ea.
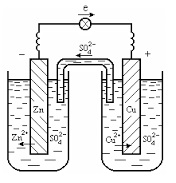
Interacțiunea dintre soluție și placă, care acționează ca un electrod, ajută electrodul să devină încărcat electric. Diferența potențială care apare la interfața metalo-electrolitică se numește potențialul electrodului. Sensul și semnul său (+ sau -) sunt determinate de natura soluției și de metalul din ea. Atunci când metalele sunt scufundate în soluții ale sărurilor lor, cele mai active (Zn, Fe etc.) sunt încărcate negativ, iar cele mai puțin active (Cu, Ag, Au etc.) sunt pozitive.
Rezultatul conectării plăcii de zinc și cupru de conductorul de electricitate este apariția unui curent electric în circuit datorită fluxului de electroni de la zinc la placa de cupru de-a lungul conductorului.
În acest caz, numărul de electroni din zinc scade, care este compensat prin tranziția Zn2 + în soluție, adică există dizolvarea electrodului de zinc - anod (procesul de oxidare).
La rândul său, creșterea numărului de electroni din cupru este compensată de epuizarea ionilor de cupru conținute în soluție, ceea ce duce la acumularea de cupru pe un catod electrod-cupru (procesul de reducere):
Astfel, următoarea reacție are loc în element:
Din punct de vedere cantitativ, procesele de oxidare-reducere sunt permise de potentialele electrodului, masurate in raport cu electrodul normal de hidrogen (potentialul sau se presupune a fi zero).
Pentru a determina potențialul electrodului standard, utilizați un element, unul dintre acești electrozi fiind metalul test (sau nemetal), iar celălalt este un electrod hidrogen. Din diferența de potențial găsită la polii elementului, se determină potențialul normal al metalului supus investigației.
Potențial de reducere a oxidării
Valorile potențialului de reducere a oxidării sunt utilizate, dacă este necesar, pentru a determina direcția de reacție în soluții apoase sau alte soluții.
astfel încât ionii de iodură și ionii de fier își schimbă electronii printr-un conductor. În recipientele care conțin soluții de Fe 3+ și I -. plasăm electrozi inerți (platină sau carbon) și închidem lanțurile interioare și exterioare. Un curent electric apare în circuit. Iodurile de ioduri renunță la electronii lor, care vor curge de-a lungul conductorului la un electrod inert imersat într-o soluție de sare Fe 3+:
Procesele de oxidare-reducere apar la suprafața electrozilor inerți. Potențialul care apare la limita unei soluții inerte de electrod și conține atât o formă oxidată cât și o formă redusă a unei substanțe se numește potențial redox de echilibru. Semnificația potențialului de reducere a oxidării depinde de mulți factori. inclusiv:
- Natura substanței (oxidant și agent de reducere)
- Concentrarea formelor oxidate și reduse. La o temperatură de 25 ° C și o presiune de 1 atm. valoarea potențialului de reducere a oxidării se calculează utilizând ecuația Nernst:
E - potențial de reducere a oxidării - acestei perechi;
E ° este potențialul standard (măsurat la Coc = Csw);
R este constanta gazului (R = 8,314 J);
T este temperatura absolută, K
n este cantitatea de electroni produsi sau primiti in procesul de oxidare-reducere;
F - Constanta Faraday (F = 96484,56 Cl / mol);
Cocsul este concentrația (activitatea) formei oxidate;
Cvos este concentrația (activitatea) formei reduse.
Înlocuind datele cunoscute în ecuație și mergând la logaritmul zecimal, obținem următoarea formă a ecuației:
- Aciditatea soluției. Pentru perechi a căror formă oxigenată conține oxigen (de exemplu, Cr2O7 2-CrO4-2, MnO4-), deoarece pH-ul soluției scade, crește potențialul de reducere a oxidării, adică potențialul crește cu creșterea H +. Dimpotrivă, potențialul de reducere a oxidării scade cu scăderea H +.
- Temperatura. Cu o temperatură în creștere, potențialul de reducere a oxidării acestei perechi crește și el.
Standardele potențiale de reducere a oxidării sunt prezentate în tabelele cărților de referință speciale. Trebuie remarcat faptul că sunt luate în considerare numai reacțiile în soluții apoase la o temperatură de ≈ 25 ° C. Astfel de tabele permit să se tragă unele concluzii:
- Amploarea și semnul potențialelor redox standard. ne permite să anticipăm care proprietăți (oxidative sau reducătoare) vor manifesta, de exemplu, atomi, ioni sau molecule în reacțiile chimice
E ° (F2 / 2F-) = +2,87 V este cel mai puternic oxidant
E ° (K + / K) = - 2.924 V - cel mai puternic reductor
Această pereche va avea o capacitate de reducere mai mare, cu cât valoarea numerică a potențialului său negativ este mai mare și cu cât este mai mare potențialul pozitiv, cu atât este mai mare capacitatea de oxidare.
- Este posibil să se determine care dintre compușii unui element vor avea cele mai puternice proprietăți oxidante sau de reducere.
- Este posibil să se prezică direcția OVR. Se știe că funcționarea unei celule galvanice are loc cu condiția ca diferența de potențial să aibă o valoare pozitivă. De asemenea, debitul OVR în direcția aleasă este posibil dacă diferența de potențial are o valoare pozitivă. OVP curge spre oxidanți mai slabi și agenți reducători de la cei mai puternici, de exemplu, reacția
Sn 2+ + 2 Fe 3+ = Sn 4+ + 2 Fe 2+
Practic curge în direcția înainte, pentru că
Cu + Fe 2+ = Cu 2+ + Fe
Este imposibil în direcția înainte și curge numai de la dreapta la stânga, deoarece
În procesul OBD, cantitatea de substanțe inițiale scade, ca urmare a căderii oxidantului E, iar E al agentului reducător crește. La sfârșitul reacției, adică Când se instalează echilibrul chimic, potențialul ambelor procese este egalat.
- Dacă mai multe OBP-uri sunt posibile în condițiile date, atunci reacția va avea loc mai întâi, în care diferența dintre potențialele de reducere a oxidării este cea mai mare.
- Folosind datele de referință, este posibil să se determine emf-ul reacției.
Deci, Cum de a determina reacția emf?
Să luăm în considerare mai multe reacții și să ne definim EMF:
E ° (Mg2 + / Mg) = - 2,36 V
E ° (Fe 2+ / Fe) = -0,44 V
Pentru a determina emf-ul reacției, este necesar să se găsească diferența dintre potențialul oxidantului și potențialul agentului reducător
EMF = E 0 ok - E 0 creștere
- Emf = - 0,44 - (- 2,36) = 1,92 V
- EMF = 0,00 - (- 2,36) = 2,36 V
- EMF = + 0,34 - (- 2,36) = 2,70 V
Toate reacțiile de mai sus pot curge în direcția înainte, deoarece EMF> 0.
Constanta de echilibru.
Dacă este nevoie să determinăm gradul de reacție, atunci putem folosi constanta de echilibru.
De exemplu, pentru reacție
Zn + Cu 2+ = Zn 2+ + Cu
Aplicarea legii maselor care acționează. pot fi scrise
Aici, constanta de echilibru K arată raportul de echilibru al concentrațiilor de ioni de zinc și cupru.
Valoarea constantei de echilibru poate fi calculată prin aplicarea ecuației Nernst
Substituim în ecuație valorile potențialelor standard ale perechilor Zn / Zn 2+ și Cu / Cu 2+. noi găsim
Valoarea constantei de echilibru arată că reacția continuă aproape până la sfârșit, adică până când concentrația ionilor de cupru este de 10 37,7 ori mai mică decât concentrația de ioni de zinc.
Constanta de echilibru și potențialul de reducere a oxidării sunt legate de formula generală:
K este constanta de echilibru
E10 și E20 sunt potențialele standard ale agentului de oxidare și, respectiv, de reducere
n este numărul de electroni livrați de agentul reducător sau preluați de oxidant.
Dacă E1 0> E2 0. atunci lgK> 0 și K> 1. De aceea, reacția are loc în direcția înainte (de la stânga la dreapta) și dacă diferența (E1 0 - E2 0) este suficient de mare, atunci ea se apropie aproape de final.
Dimpotrivă, dacă E1 0 Cunoașterea valorii constantei de echilibru. fără a recurge la date experimentale, se poate judeca adâncimea reacției chimice. Ar trebui să se țină cont de faptul că aceste valori ale potențialelor standard nu permit determinarea ratei la care se stabilește echilibrul reacției. Conform datelor tabelelor de potențial redox, este posibil să se găsească valorile constantelor de echilibru pentru aproximativ 85.000 de reacții. Oferim recomandările IUPAC, care ar trebui folosite pentru a scrie corect circuitele celulelor galvanice și reacțiile care apar în ele: Astfel, atunci când se compune circuitul unei celule galvanice, un electrod pe care are loc procesul de oxidare (anod) se înregistrează la stânga, iar electrodul pe care are loc procesul de reducere (catod) este pe dreapta. De exemplu, vom elabora o schemă a unei celule galvanice. în care se efectuează următoarea reacție: În celula galvanică, anodul este un electrod de fier, iar catodul este un electrod cadmiu. Sarcini tipice cu soluții găsiți aici.
Cum de a elabora un circuit al unei celule galvanice?
Articole similare
Trimiteți-le prietenilor: