Ca și alte proteine funcționale, enzimele sunt împărțite în simple și complexe. Enzimele simple sunt proteine simple, sunt construite din aminoacizi și se descompun în aminoacizi numai în timpul hidrolizei. Enzimele complexe sunt proteine complexe, ele conțin o proteină simplă și o componentă non-proteică. În timpul hidrolizei lor, în plus față de aminoacizii liberi, se eliberează partea neproteică sau produsele de dezintegrare.
Partea proteică a enzimei complexe se numește apoenzima, partea neproteinică este cofactorul. Cofactorii pot avea o natură chimică diferită și diferă în puterea legăturii cu apoenzima. În rolul unui cofactor, pot acționa ioni de diferite metale, precum și alți ioni anorganici.
Substanțele organice de natură non-aminoacidă, utilizate ca cofactori, se numesc coenzime. Coenzima împreună cu apoenzima formează o holoenzimă.
Coenzima + Apoenzima ↔ Holoenzima
În unele cazuri, într-un echilibru celulă vie în această reacție este puternic deplasat spre dreapta și coenzimei este puternic asociat cu partea sa de proteine, acestea nu sunt separate de izolare și purificare. Această coenzima se numește grup protetic.
Trebuie remarcat o trăsătură distinctivă a enzimelor complexe este faptul că nici un co-factor (inclusiv coenzima), nici apoenzimei însuși posedă activitate catalitică nu numai unificarea lor într-o singură unitate oferă o reacție chimică rapidă.
Coenzimele se referă la substanțe organice complexe, moleculele acestora fiind mult mai mici decât moleculele de enzime. Coenzimele pot pătrunde în membranele biologice, încălzirea, de obicei, nu provoacă o modificare a structurii lor.
Funcția coenzimei este participarea la reacția catalizată, iar cantitatea enzimei și structura sa chimică rămân în exterior neschimbate. De fapt, coenzima este unul dintre substraturile reacției enzimatice, adică acționează ca un co-extraterestru. În timpul reacției, coenzima suferă transformări chimice, exact opusul celor care au loc în substrat. De exemplu, în reacțiile de oxidare-reducere, molecula substratului este oxidată și molecula de coenzima este restabilită. În reacțiile conjugate ulterioare, schimbările în coenzimă se desfășoară în direcția opusă și sunt reproduse în forma sa originală.
Astfel, coenzimele pot fi caracterizate ca purtători ai anumitor atomi, electroni sau grupări chimice la acceptorul corespunzător. Structura apenenzimei determină specificitatea acestei reacții, iar structura coenzimelor este tipul ei.
Prin origine și structura chimică, coenzimele pot fi împărțite în vitamine (vitamine) și non-vitamine. Primul grup include derivații vitaminelor B solubili în apă. De asemenea, nucleozidele adenil pot fi incluse în compoziția lor. Caracteristicile structurii și funcției coenzimelor vitaminice sunt prezentate în tabel.
Coenzimele peptidice și nucleotidice sunt primele care urmează să fie utilizate pentru coenzimele non-vitamine.
Glutationul este o coenzima peptidică. Conform structurii chimice, aceasta este o tripeptidă # 947; -glutamil-cisteinil-glicină. Reactivitatea sa este determinată de gruparea SH a cisteinei, care intră ușor în reacții redox. Prin urmare, glutationul poate fi în forma redusă (G-SH) și oxidată (G-S-S-D). În celulă, glutationul este prezent predominant într-o formă redusă. Funcția sa principală este că glutationul protejează grupul SH de enzime din oxidare și formează tioli din disulfuri.
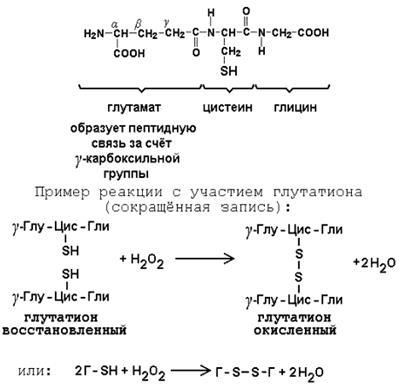
Figura 6 - Reacții cu glutation
Adenozin trifosfat (ATP) este o coenzima de natură nucleotidică. Acesta conține adenină de bază purină, riboză carbohidrat și trei reziduuri de acid fosforic. Acest compus conține energie bogate legături (bogate în energie) și fosfat pot lua parte la reacții complexe de sinteza de substanțe, și, de asemenea, servi ca donor de grup fosfat.
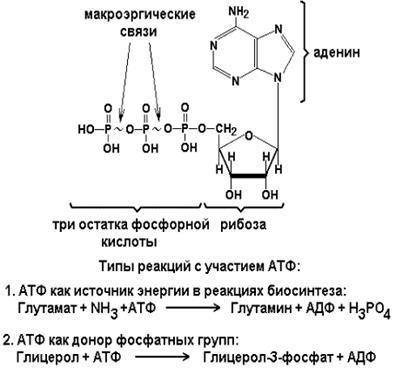
Figura 7 - Adenozin trifosfat (ATP)
Partea non-proteică a enzimei complexe poate fi, de asemenea, reprezentată prin ioni metalici. Enzimele care conțin ioni metalici în compoziția lor se numesc metaloenzime (de exemplu, # 945; -amilaza include ioni de Ca2 +, care participă la stabilizarea structurii spațiale a enzimei). Eliminarea acestor ioni duce la pierderea activității enzimatice. În alte cazuri, ionii metalici pot servi ca activatori ai enzimelor - reacția poate avea loc și în absența acestor ioni.
Multe coenzime și grupări prostetice de enzime sunt derivate din vitamine - substanțe organice care nu sunt sintetizate în corpul uman și ar trebui să acționeze ca o parte a hranei. Se numesc coenzime de vitamine. În molecula unei astfel de coenzime, ingredientul activ care se leagă la grupul transferat este tocmai vitamina. Restul moleculei de coenzima asigură legarea specifică la apoenzima într-o orientare strict definită. Bolile care apar la om, cu o deficienta de vitamine in dieta, sunt o consecință a bolilor metabolice prin reducerea concentrației de coenzime specifice, reacțiile enzimatice.
Cea mai importantă dintre coenzimele vitaminice sunt:
Thiamin difosfatul (TDF) este un derivat al vitaminei B1; participă la reacțiile de decarboxilare oxidativă a acidului piruvic și piruvic # 945; - acizi ketoglutarici. Formula sa este prezentată în figură.
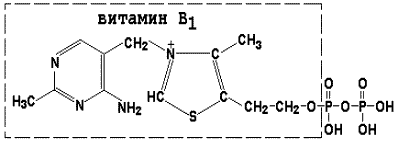
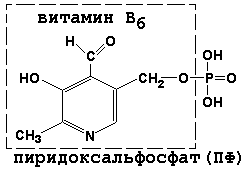
Pyridoxal fosfatul este un derivat al vitaminei B6; participă la reacțiile de transaminare ale aminoacizilor. Formula sa este prezentată în figură.
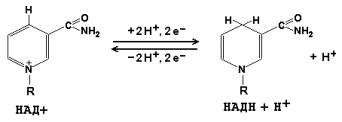
Coenzima NAD + (nicotinamid adenin dinucleotid) și NADP + (nicotinamid adenin dinucleotid fosfat) conțin în compoziție și vitamina PP lor care participă la reacții redox. Formele recuperate ale acestei coenzime sunt denumite NADH și, respectiv, NADPH. Forma pentru coenzima NAD + este prezentată în figură; structura NADP + diferă prin prezența unei alte grupări fosfat în a doua poziție a ribozei adenil nucleotidice.
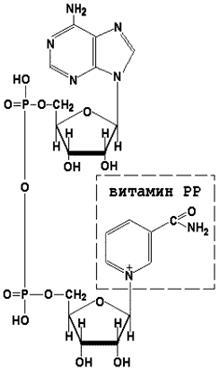
Formarea formelor reduse de coenzime de nicotinamidă este prezentată în diagrama:
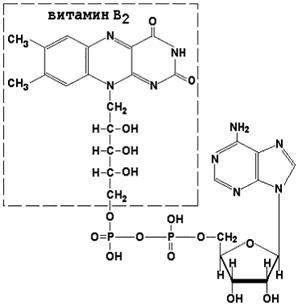
FAD Coenzima (flavin adenin dinucleotid) și FMN (flavin mononucleotidă) conțin în compoziție și vitamina B2 lor sunt implicate în reacții redox. Formele recuperate ale acestei coenzime sunt indicate prin FADN2 și, respectiv, FMNH2.
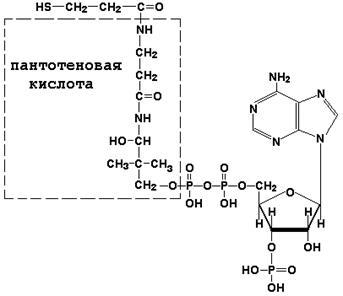
Coenzima A (CoA-SH) este un derivat de vitamina B3 (acid pantotenic) și participă la reacțiile de transfer de reziduuri de acizi grași (reacții de acilare).
5,6,7,8-tetrahidrofolic (acid tetrahidrofolic) este un derivat al vitaminei D (acid folic) și este implicat în transferul grupe reacțiile unu carbon: metil (CH3), metilen (-CH2-), metenilnoy (-CH =), formil (-SON) și altele.
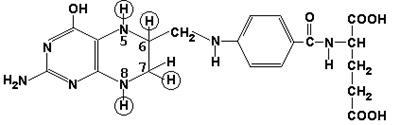
Metilcobalamina (conține vitamina B12) și participă, de asemenea, la transferul grupării metil.
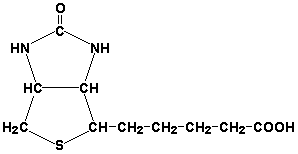
Biotina (vitamina H) este implicată în activarea CO2 și transferul grupărilor carboxil (reacții de carboxilare).
În prezent, peste două mii de reacții chimice sunt catalizate de enzime, iar acest număr este în continuă creștere. Pentru a naviga într-o mulțime de transformări. A existat o nevoie urgentă de clasificare și nomenclatură sistematizată, prin care orice enzimă ar putea fi identificată cu precizie. Nomenclatura, care a fost folosită până la mijlocul secolului XX, a fost foarte departe de a fi perfectă. Cercetătorii, descoperind o nouă enzimă, i-au dat un nume la discreția sa, ceea ce a dus în mod inevitabil la confuzie și tot felul de contradicții. Unele nume s-au dovedit a fi greșite, altele nu au spus nimic despre natura reacției catalizate. Oamenii de știință din diferite școli folosesc adesea nume diferite pentru aceeași enzimă sau, invers, același nume pentru mai multe enzime diferite.
Clasificarea se bazează pe cea mai importantă caracteristică, conform căreia o enzimă diferă de o altă enzimă - reacția este catalizată de aceasta. Numărul de tipuri de reacții chimice este relativ mic, ceea ce a făcut posibilă divizarea tuturor enzimelor cunoscute în prezent în 6 clase importante, în funcție de tipul de reacție catalizată. Astfel de clase sunt:
oxidoreductaza (reacții de reducere a oxidării);
transferaza (transfer de grupuri functionale);
hidrolaze (reacții de scindare care implică apă);
liză (ruperea legăturilor fără apă);
izomeraze (transformări izomerice);
ligaza (sinteza cu costul moleculelor ATP).
Enzimele din fiecare clasă sunt împărțite în subclase, ghidate de structura substraturilor. În subclase, enzimele care acționează pe substraturi construite similar sunt combinate. Subclasele sunt împărțite în sub-subclase, în care structura grupurilor chimice care diferențiază substraturile unele de altele este și mai riguroasă. Sub-subclasele din interiorul enumeră enzimele individuale. Toate unitățile de clasificare au numere proprii. Astfel, orice enzimă își primește numărul unic de cod constând din patru numere separate prin puncte. Primul număr denotă clasa, al doilea subclasa, a treia subclasă, al patrulea numărul enzimei din subclasă. De exemplu, o enzimă Amidonul de despicare este desemnat ca 3.2.1.1, unde:
3 - tipul de reacție (hidroliză);
2 - tipul conexiunii în substrat (glicozid);
1 - un fel de comunicare (O-glicozid);
1 - numărul enzimei din subclasă.
Referindu-se la clasificarea enzimelor, ar trebui de asemenea remarcat faptul că enzimele nu sunt clasificate ca substanțe individuale, ci ca și catalizatori pentru anumite transformări chimice. Enzimele izolate din diferite surse biologice și catalizând reacțiile identice pot fi diferite în structura lor primară. Cu toate acestea, în lista de clasificare, toate acestea apar sub același cod.
Cunoașterea numărului de cod enzimatic permite:
eliminarea ambiguităților dacă cercetătorii folosesc același nume pentru diferite enzime;
să facă căutarea în baze de date literare mai eficientă;
obține în alte baze de date informații suplimentare privind secvența aminoacizilor, structura spațială a enzimei, genele care codifică proteinele enzimatice.
Sistemul de clasificare elaborat de Comisie cu privire la enzime include, de asemenea, o nomenclatură nou creată de enzime, care este construită pe principii speciale. În conformitate cu recomandările IUBMB, enzimele au două tipuri de nume: sistematice și operaționale (recomandate). Numele sistematic este alcătuit din două părți. Prima parte conține numele substratului sau substraturilor, adesea denumirea coenzimei, a doua parte indică natura reacției catalizate și include numele clasei căreia îi aparține enzima. Dacă este necesar, informațiile suplimentare privind reacția în paranteze sunt date după a doua parte a titlului. Un nume sistematic este atribuit numai acelor enzime ale căror acțiuni catalitice sunt pe deplin studiate.
De exemplu, numele sistematic # 945; -amilaze-1,4- # 945; -D-glucan-glucan hidrolaza. Desigur, acest nume este foarte incomod pentru amintirea și pronunțarea. Prin urmare, împreună cu Comisia sistematică privind enzimele, IUBMB recomandă utilizarea denumirilor enzimatice de lucru (simplificate).
Regulile de bază pentru construirea denumirilor sistematice și funcționale pentru diferite clase de enzime:
Denumirea sistematică a enzimelor din această clasă este construită în conformitate cu schema donatorilor: acceptorul - oxidoreductaza. Conform nomenclaturii triviale, oxidoreductazele care separă atomii de hidrogen sau electronii și le transferă către orice alt acceptor decât oxigenul sunt numite dehidrogenaze. Oxidoreductazele care utilizează oxigenul ca acceptor de atomi de hidrogen sau de electroni se numesc oxidaze. Unele enzime, care au un efect predominant de restabilire, se numesc reductază. Toate aceste nume pot fi folosite pentru a construi un nume de lucru pentru oxidoreductaze.
Denumirea sistematică a enzimelor care accelerează astfel de reacții este sub forma unui donator: un acceptor (grup transportabil) de transferază. Titlul de lucru indică de obicei numai un singur substrat sau produs specific, împreună cu numele grupării transportate.
Numele sistematic este compilat în funcție de forma substratului-hidrolază. În hidrolaze, în special scindarea unui anumit grup, acest grup poate fi indicat sub forma unui prefix. Denumirea de lucru se compune cel mai adesea din numele substratului hidrolizabil cu adăugarea capătului -aaa. Trebuie remarcat totuși că, din cauza naturii destul de complexe și adesea neexplorate a specificității multor hidrolaze, nu este întotdeauna posibil să le oferim un nume sistematic. În aceste cazuri, se recomandă utilizarea denumirilor empirice care le sunt atribuite în prima descriere. Astfel, astfel de enzime ca pepsina, papaina, trombina nu au un nume sistematic.
Denumirea sistematică a enzimelor este construită în conformitate cu schema: gruparea-lizat a grupării substrat. Pentru a specifica grupul care este împărțit, se folosesc prefixele "carboxi-", "amoniac", "hidro-" etc. Ca nume de lucru ale enzimelor, există nume triviale, cum ar fi "decarboxilază", "aldolază", "dehidratază", "desulfhidraz". Lieses sunt împărțite în subclase în funcție de natura legăturilor care sunt rupte.
Denumirea sistematică a enzimelor include denumirea substratului și termenul izomerază, care este precedată de o indicație a tipului de reacție de izomerizare. Titlurile de lucru sunt similare (cu unele simplificări) cu numele sistemelor.
Numele sistematic este format din numele substraturilor care urmează să fie combinate în legătură cu cuvântul ligază. Produsul format ca urmare a hidrolizei trifosfatului de nucleozidă este indicat în paranteze. Denumirea activă a enzimelor din această clasă este, de obicei, compusă din denumirea produsului de reacție în combinație cu cuvântul sintetază.
Articole similare
Trimiteți-le prietenilor: