C (grafit) + O2 (r) = CO2 (r) # 916; H.
Să ne imaginăm sub forma unei scheme:
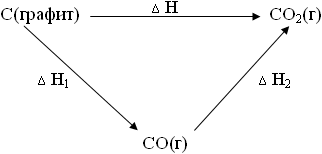
Aceasta înseamnă că dacă toate cele trei procese satisfac cerința Tisch. = Sfârșit. și Fig. = Sfârșit ... atunci indiferent dacă grafitul arde imediat în CO2 sau mai întâi în CO și apoi CO în CO2. Efectul termic va fi același.
Consecințele din legea lui Hess:
- În cazul în care, ca urmare a reacțiilor chimice succesive în sistemul ajunge la o stare coincide complet cu (procesul de rotație) de pornire, suma efectelor termice ale acestor reacții vor fi zero.
- Efectul termic al reacțiilor (# 916; Hx.r.) este egal cu suma încălzirii formării (sau # 916; Nobr. ) Substanțe finite (# 916; Nkonech in-in) minus suma căldurilor de formare a materiilor prime (# 916, in-Descendent in) ..:
Potențialul izobar-izotermic (energia Gibbs)
Din ceea ce a fost considerat mai devreme rezultă că în procesele chimice există simultan două tendințe:
1. Dorința particulelor de a se uni în mai complexe, ceea ce reduce entalpia.
2. Dorința particulelor de a se deconecta, crește tulburarea, ceea ce crește entropia.
Efectul cumulat al acestor două tendințe opuse în procesele care au loc la temperatură constantă și presiune constantă, schimbarea reflectă izobară-izotermă (sau pentru scurt - izobară) Capacitate # 916; G:
G = # 916; H-T # 916; S,
unde H - schimbare în eptalpia (conținutul de căldură al sistemului), kJ / mol;
S - schimbarea entropiei (măsurători ale tulburărilor sistemelor), J / mol • K;
T este temperatura, K.
Potențialul izobar este măsurat în kcal / mol sau kJ / mol.
Natura schimbărilor G vă permite să judecați posibilitatea principală sau imposibilitatea procesului:
În cazul în care G <0, т. е. изобарный потенциал в ходе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно (спонтанно).
În cazul în care G> 0, atunci este imposibil să executați procesul în aceste condiții.
În cazul în care G = 0, se observă starea echilibrului chimic.
Nu întregul răspuns. Pe partea de acolo!
Viteza de reacție poate fi exprimată ca o modificare a cantității de substanță (n, în valoare absolută) pe unitatea de timp (t) - compară viteza corpului în mișcare în fizică ca o schimbare de coordonate pe unitatea de timp: # 965; = # 916; x / # 916; Pentru ca viteza să nu depindă de volumul vasului în care are loc reacția, divizăm expresia prin volumul substanțelor reactive (v), adică obținem o modificare a cantității de materie per unitate de timp pe unitate de volum sau o modificare a concentrației uneia dintre substanțe pe unitate de timp:
unde c = n / v este concentrația substanței,
Condiții care afectează rata reacțiilor chimice
1) Rata de reacție depinde de natura reactanților. Pur și simplu, substanțele diferite reacționează la diferite rate. De exemplu, zincul reacționează violent cu acidul clorhidric, iar fierul este destul de lent.
2) Rata de reacție este mai mare, cu atât concentrația substanțelor este mai mare. Cu acidul foarte diluat, zincul va reacționa mult mai mult.
3) Rata de reacție crește semnificativ cu creșterea temperaturii. De exemplu, pentru arderea combustibilului este necesar să-l aprindeți, adică ridicați temperatura. Pentru multe reacții, o creștere a temperaturii de 10 ° C este însoțită de o creștere a vitezei de 2-4 ori.
4) Rata reacțiilor eterogene crește cu suprafața substanțelor care reacționează. Substanțele solide pentru aceasta sunt de obicei pulverizate. De exemplu, la fier și pulberi de sulf, atunci când sunt încălzite pentru a reacționa, fierul trebuie să fie sub formă de rumeguș mic.
Rețineți că în acest caz, înțelegem formula (1)! Formula (2) exprimă viteza pe unitate de suprafață și, prin urmare, nu poate depinde de zonă.
5) Rata de reacție depinde de prezența catalizatorilor sau a inhibitorilor.
Catalizatorii sunt substanțe care accelerează reacțiile chimice, dar nu sunt consumate în același timp. Un exemplu este descompunerea rapidă a peroxidului de hidrogen cu adăugarea unui catalizator - oxid de mangan (IV):
Oxidul de mangan (IV) rămâne pe fund, poate fi refolosit.
Inhibitorii sunt substanțe care încetinesc reacția. De exemplu, pentru a prelungi durata de viață a țevilor și a bateriilor, se adaugă inhibitori de coroziune la sistemul de încălzire a apei. În mașini, se adaugă inhibitori de coroziune la lichidul de răcire al frânei.
Activitatea catalizatorului scade brusc în prezența substanțelor numite otrăvuri catalitice. Dacă catalizatorul și reactanții sunt în aceeași stare agregată, de obicei gazoasă sau lichidă, se consideră că cataliza este omogenă. Ca catalizatori în cataliza omogenă, apar adesea soluții de acizi, baze, săruri ale elementelor d, solvenți. Cataliza este eterogenă. dacă catalizatorul și reactanții sunt în diferite stări agregate sau formează faze separate. În rolul catalizatorilor, substanțele solide, de obicei d-elementele sau compușii lor, sunt cele mai des folosite în acest caz. Catalizatorii nu modifică entalpia și energia Gibbs a reacției și nu afectează poziția de echilibru chimic a reacției. Catalizatorii cresc doar rata reacțiilor directe și inverse.
Distingeți între sistemele omogene și eterogene. Omogen este un sistem alcătuit dintr-o fază, eterogenă - un sistem alcătuit din mai multe faze. O fază este o parte a sistemului separată de celelalte părți printr-o suprafață a interfeței, trecerea prin care proprietățile se schimbă brusc.
Echilibrul chimic în sistemele omogene
Când factorii de entalpie și entropie sunt egali # 916; H = T # 916; G = 0, care este starea termodinamică a echilibrului chimic. Echilibrul chimic este dinamic. Rata de reacție (numărul de particule formate per unitate de timp per unitate de volum) în direcția înainte este egală cu viteza de reacție în direcția inversă. În acest moment, concentrațiile substanțelor inițiale și ale produselor de reacție nu se modifică în timp și se numesc concentrații de echilibru. Acestea sunt notate cu simbolul substanței în paranteze pătrate.
Articole similare
Trimiteți-le prietenilor: