13. Interacțiunea metalelor cu soluții alcaline.
13. Interacțiunea metalelor cu soluții alcaline. Cu soluții apoase de alcalii, metalele care interacționează în seria de tensiuni la hidrogen și care corespund oxizilor amfoterici. metale corespunzătoare oxizilor amfoterici: Al, Cr, Zn, Be, Pb, Sn, Sb. 2Al + 2NaOH + 6H2O = 2Na [Al (OH) 4] + 3H2 ↑
Interacțiunea metalelor cu soluții alcaline.
Metalele, cum ar fi natura lor, nu interacționează cu atomii de hidrogen ai grupării hidroxil în moleculele de bază. Dar unele dintre ele sunt soluții alcaline. Cu alcalii, metalele care dau hidroxizi amfoterici sau posedă grade înalte de oxidare în prezența oxidanților puternici pot interacționa. Atunci când metalele interacționează cu soluții de alcalii, oxidantul este apa. Un exemplu. Zn + 2NaOH + 2H2O = Na2 [Zn (OH) 4] + H2 ↑ (pagina 122 helper) 0 1 Zn + 4OH - - 2e = [Zn (OH) 4] 2- oxidarea Zn 0 - 1 reducătorului 2H2O + 2e = H2 + 2OH - recuperarea H2O - oxidant Zn + 4OH - + 2H2O = [Zn (OH) 4] 2- + 2OH - + H2 ↑ Fier având un grad înalt de oxidare, poate reacționa cu alcalii în alierea: 4NB + 5O2 + 12KOH = 4K3 NbO4 + 6H2O
14. Calcularea compoziției unui amestec de metale cu cantitatea de gaz eliberat în reacție cu un alcalin sau cu un acid.
14. Calcularea compoziției unui amestec de metale cu cantitatea de gaz eliberat în reacție cu un alcalin sau cu un acid. Pentru a determina conținutul (masă%) de zinc într-un lot metalic tehnic, o probă cântărind 800 mg a fost tratată cu exces de acid clorhidric. Volumul (nu) de hidrogen eliberat a fost de 262 ml. Se calculează rezultatul încercării probei.
prin ecuația de reacție 1 mol; 22,4 l / mol H2 - 1 mol; 65 g / mol Zn
de starea problemei, 0,262 L H2 - Xr Zn
EXEMPLUL 1 Când o cantitate de 20 g de cupru și fier a fost amestecată cu un exces de acid clorhidric, s-au eliberat 5,6 litri de gaz (nos). Determinați fracția de masă a metalelor din amestec.
În primul exemplu, cuprul nu reacționează cu acidul clorhidric, adică hidrogenul este eliberat în timpul reacției acidului cu fierul. Astfel, știind volumul de hidrogen, putem găsi imediat cantitatea și masa de fier. Și, în consecință, fracțiunile de masă ale substanțelor din amestec.
Soluția din exemplul 1.
Se constată cantitatea de hidrogen: n = V / Vm = 5,6 / 22,4 = 0,25 mol.
Prin ecuația de reacție:
Cantitatea de fier este, de asemenea, 0,25 mol. Puteți găsi masa lui: mFe = 0,25 • 56 = 14 g.
Acum putem calcula fracțiile de masă ale metalelor în amestec: ωFe = mFe / m toate amestecurile = 14/20 = 0.7 = 70%
Răspuns: 70% fier, 30% cupru.
Când un amestec de 11 g de aluminiu și fier a fost aplicat amestecului unui exces de acid clorhidric, s-au eliberat 8,96 litri de gaz (nos). Determinați fracția de masă a metalelor din amestec.
În al doilea exemplu, ambele metale intră în reacție. Aici, hidrogenul din acid este eliberat în ambele reacții. Prin urmare, calculul direct nu poate fi folosit aici. În astfel de cazuri, este convenabil să se rezolve cu un sistem foarte simplu de ecuații, presupunând pentru x numărul de moli ai unuia dintre metale și pentru y cantitatea celei de-a doua substanțe.
Soluția din exemplul 2.
Se găsește cantitatea de hidrogen: n = V / Vm = 8,96 / 22,4 = 0,4 mol.
Lăsați cantitatea de aluminiu să fie x mol, iar fierul la mol. Apoi putem exprima în termeni de x și y cantitatea de hidrogen eliberată:
Numărul de moli de hidrogen: nH2 = 3,36 / 22,4 = 0,15 mol, raportul molar dintre aluminiu și hidrogen este 2: 3 și, în consecință, nAl = 0,15 / 1,5 = 0,1 mol. Greutatea aluminiului: mAl = n • M = 0,1 • 27 = 2,7 g
Restul este fier, cântărind 3 g. Puteți găsi masa amestecului: m mix = 16 + 2,7 + 3 = 21,7 g.
Fracții de masă ale metalelor:
Răspuns: 73,73% cupru, 12,44% aluminiu, 13,83% fier.
Exemplul 5.21.1 g dintr-un amestec de zinc și aluminiu a fost dizolvat în 565 ml soluție de acid azotic conținând 20% % HNO3 și având o densitate de 1,115 g / ml. Volumul gazului eliberat, care este o substanță simplă și singurul produs al reducerii acidului azotic, a fost de 2.912 litri (nu). Se determină compoziția soluției rezultate în procente de greutate. (RCTU)
Textul acestei probleme indică în mod clar produsul reducerii azotului - "materie simplă". Deoarece acidul azotic cu metale nu produce hidrogen, este azot. Ambele metale dizolvate în acid. În această problemă nu ne cerem compoziția amestecului inițial de metale, ci compoziția soluției obținute după reacții. Acest lucru face sarcina mai complicată.
Soluția din exemplul 5.
Determinați cantitatea de substanță gazoasă: nN2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
Se determină masa soluției de acid azotic, masa și cantitatea de substanță HNO3 dizolvată:
mrastvora = ρ • V = 1,115 • 565 = 630.3 g mHNO3 = ω • mrastvora = 0,2 • 630,3 = 126,06 g nHNO3 = m / M = 126,06 / 63 = 2 mol
Rețineți că, deoarece metalele s-au dizolvat complet, înseamnă - acidul este suficient (cu apă aceste metale nu reacționează). În consecință, va fi necesar să se verifice dacă acidul a fost în exces. și cât a rămas după reacție în soluția rezultată.
Formăm ecuațiile de reacție (nu uitați de echilibrul electronic) și, pentru comoditatea calculelor, luăm pentru 5x - cantitatea de zinc și pentru 10y - cantitatea de aluminiu. Apoi, în concordanță cu coeficienții din ecuațiile de azot în prima reacție, obținem x mol, iar în al doilea - 3 moli:
Următoarea întrebare este: a rămas acidul azotic în soluție și cât a mai rămas? Conform ecuațiilor de reacție, cantitatea de acid reacționată: nHNO3 = 0,48 + 1,08 = 1,56 mol, adică acidul a fost în exces și este posibil să se calculeze reziduul în soluție: nHNO3 ost. = 2 - 1,56 = 0,44 mol.
Deci, în soluția finală conține:
azotat de zinc într-o cantitate de 0,2 mol: mZn (NO3) 2 = n • M = 0,2 • 189 = 37,8 g de azotat de aluminiu într-o cantitate de 0,3 mol: MAL (NO3) 3 = n • M = 0, 3 • 213 = 63,9 g exces de acid azotic în cantitate de 0,44 mol: mHNO3 ost. = n • M = 0,44 • 63 = 27,72 g
Care este masa soluției finale? Amintiți-vă că masa soluției finale constă din acele componente pe care le-am amestecat (soluții și substanțe) minus acele produse de reacție care au lăsat soluția (precipitații și gaze):
Masa soluției noi
Suma maselor soluțiilor și / sau substanțelor miscibile
Apoi pentru problema noastră:
mnov. soluție = masa soluției de acid + masa aliajului metalic - masa de azot mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 gm. soluție = 630,3 + 21,1-3,36 = 648,04 g
Acum puteți calcula fracția de masă a substanțelor din soluția rezultată:
Răspuns: 5,83% azotat de zinc, 9,86% nitrat de aluminiu, 4,28% acid azotic.
Exemplul 6. La prelucrarea de 17,4 g dintr-un amestec de cupru, fier și aluminiu în exces de acid azotic concentrat este recuperat gaz 4,48 L (STP), iar acțiunea asupra amestecului de același acid clorhidric în exces în masă - 8,96 l de gaz (STP). Determinați compoziția amestecului inițial. (RCTU)
Pentru a rezolva această problemă, este necesar să reamintim, mai întâi, că acidul azotic concentrat cu un metal inactiv (cupru) dă NO2. iar fierul și aluminiu nu reacționează cu el. Acidul clorhidric, dimpotrivă, nu reacționează cu cuprul.
Răspunsul la exemplul 6 este cuprul de 36,8%, fierul 32,2%, aluminiu 31%.
Elementul galvanic - o sursă chimică de curent electric, bazată pe interacțiunea a două metale și (sau) oxizii lor în electrolit, rezultând în formarea unui circuit închis de curent electric. Numit după Luigi Galvani.


Tipuri de celule galvanice: elemente cu electrozi diferiți, elemente de concentrare, elemente termohalvanice.
O celulă galvanică este un dispozitiv format din 2 electrozi, imersați într-o soluție de electroliți și conectați în afara electrolitului printr-un fir extern; dispozitiv care creează EMF ca urmare a reacțiilor chimice la electrozi.
Procesele de conversie a energiei chimice în energie electrică au loc în celule galvanice. Electrodul pe care se desfășoară procesul de oxidare se numește un anod, se consideră a fi negativ. Electrodul pe care se desfășoară procesul de reducere se numește catod, este considerat pozitiv. Electronii părăsesc elementul prin anod și se deplasează în circuitul extern la catod. Reguli de înregistrare: anodul din stânga și catodul din dreapta;

2. Procese pe electrozi.
Acțiunea oricărei celule galvanice se bazează pe apariția unei reacții de reducere a oxidării în ea. În cel mai simplu caz, o celulă galvanică constă din două plăci sau tije fabricate din metale diferite și scufundate într-o soluție de electroliți. Un astfel de sistem face posibilă separarea spațială a reacției de oxidare-reducere: oxidarea are loc pe un metal, iar reducerea are loc pe alta. Astfel, electronii sunt transferați de la agentul reducător la oxidant de-a lungul circuitului extern.
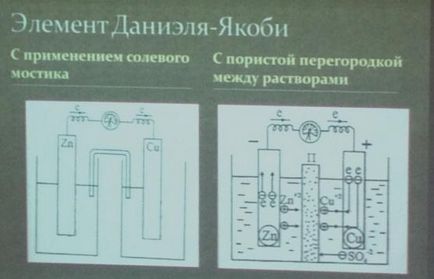
Luați în considerare, pentru operare celule galvanice exemplu de cupru-zinc prin energia reacției de mai sus între zinc și sulfat de cupru (vezi fig. 82). Acest element (elementul Jacobi - Daniel) constă dintr-o placă de cupru, cufundat într-o soluție de sulfat de cupru (electrod de cupru) și placă de zinc, cufundat într-o soluție de sulfat de zinc (electrod de zinc). Ambele soluții sunt în contact unul cu celălalt, dar pentru a preveni amestecarea, ele sunt separate printr-o perete despărțitor realizat dintr-un material poros.
.. Atunci când elementul de lucru, și anume, atunci când circuitul închis, zincul este oxidat: pe suprafața de contact cu o soluție de atomi de zinc devin ioni și hidratantă, trece în soluție. Electronii eliberați în acest proces se deplasează de-a lungul circuitului extern către electrodul de cupru. Totalitatea acestor procese este reprezentată schematic prin ecuația jumătății de reacție sau prin ecuația electrochimică:
Ionii de cupru sunt recuperați pe electrodul de cupru. Electronii care vin aici de la electrodul de zinc sunt conectați la ionii de cupru deshidratanți care părăsesc soluția; se formează atomii de cupru care sunt eliberați sub forma unui metal. Ecuația electrochimică corespunzătoare are forma:
Reacția globală ecuații care apar în celulă, veți obține prin adăugarea ecuațiile celor două jumătăți de reacții. Astfel, în timpul funcționării celulei electrochimice, electronii din agentul reducător pentru a trece oxidant printr-un circuit extern, electrozii sunt procese electrochimice observate în soluție direcționată deplasarea ionilor.
Direcția de mișcare a ionilor în soluție se datorează proceselor electrochimice care au loc la electrozi. Așa cum am menționat deja, cationii de electrozii de zinc ieșesc în soluție, creând în ea o încărcătură excesivă, iar la soluția de electrozi de cupru, dimpotrivă, tot timpul este epuizat de cationi; aici soluția este încărcată negativ. Ca rezultat, se creează un câmp electric în care cationii din soluție (Cu 2+ și Zn 2+) se deplasează de la electrodul de zinc la electrodul de cupru, iar anionii -S02- în direcția opusă. Ca urmare, lichidul celor două electrozi rămâne neutru din punct de vedere electric. Schema de mișcare a electronilor și a ionilor în timpul funcționării unui element de cupru-zinc este prezentată în Fig. 83.
Electrodul pe care are loc oxidarea se numește n o m e electrodului pe care are loc restaurarea este menționată ca m d m Într-un electrod element de zinc cupru-zinc este anod și cupru - .. Catodul.
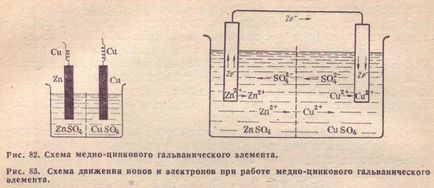
3. Rolul septului poros.
Trebuie remarcat rolul septului poros. Scopul său este numai de a preveni acțiunea mediocră a sulfatului de cupru asupra zincului. Cu acțiunea directă a sulfatului de cupru pentru energia de reacție zinc ar fi eliberat sub formă de căldură în celula electrochimică, mai degrabă decât să se transforme într-un curent electric. În unele construcții de elemente galvanice nu este necesară o partiție poroasă. Nu ar fi necesară luarea în considerare a elementelor de Daniel, în cazul în care zincul este folosit în ea era perfect curat; Zincul chimic pur, după cum a demonstrat experiența, nu interacționează cu sulfatul de cupru la contactul direct. Acumulate în apropierea suprafeței de zinc în dublu strat de zinc ioni pozitivi se resping ioni ca-încărcat de cupru și de a preveni contactul acestora cu zincul metalic.
Conceptul de potențial electrod.
Dacă placa metalică inferioară în apă, de suprafață ionii Me vor interactiona cu moleculele de apă polare. Polar molecule de apă ataca placa. În Alea în mediu apos Me iese ioni, deci interfața fazelor 2 Me / forme lichide un strat dublu electric format din ioni și electroni Me placă metalică în exces. La limita soluției Me /, apare un strat dublu electric și se stabilește un echilibru.
sau nu include apa de hidratare
Potențialul electrodului unui metal este diferența de potențial la interfața cu soluția metalică. El determină starea de echilibru a procesului electrodului. . Mărimea potențialului electrodului depinde de proprietățile metalului, de concentrația ionilor unui metal dat în soluție și de temperatura. Această dependență este exprimată prin ecuația Nernst:
Pentru soluții suficient de diluate, concentrația
R = 8,314 J K -1 mol -1 univ.haz.continuous
F = 96487 Cl mol -1 Număr Faraday
n este sarcina ionului metalic.
- potențialul electrodului standard.
Potențele electrodului sunt măsurate în raport cu electrodul normal de hidrogen. Electrodul de hidrogen este o placă din placa de burete Pt, care este coborâtă în soluția de H2S04 acid. prin care trece gazul hidrogen. Platina se referă la metale cu rezistență chimică ridicată. Hidrogenul gazos este adsorbit pe suprafața Pt. Pentru a crește capacitatea absorbantă, este acoperită cu un strat de platină spongioasă. Pe suprafața de platină saturată cu hidrogen, se stabilește un echilibru:
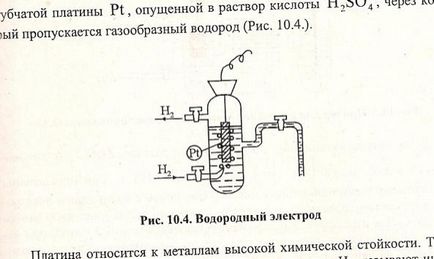
H2 Valoarea absolută a electrodului de hidrogen nu este cunoscută, dar în mod condiționat se presupune că potențialul electrodului hidrogen standard este zero. = 0 atunci când = 101325 Pa (760 mm RT) T = 298 K (25 ° C) [] = 1 mol / l
Trimiteți-le prietenilor: