Acest subiect este adesea problematic în pregătirea examenului. Deși nu este deloc dificil.
Prin urmare, mai întâi voi vorbi despre "o pondere importantă a studenților ruși" - devine clar unde "picioarele" cresc din această problemă și apoi vom analiza materialul însuși.
Am auzit cu toții despre IUPAC (Uniunea Internațională de Chimie Pură și Aplicată). În 1989, această alianță a fost propusă pentru a fi folosită în întreaga lume (și lumea întreagă a convenit și încă mai folosește) așa-numita "formă lungă" a sistemului periodic de elemente:
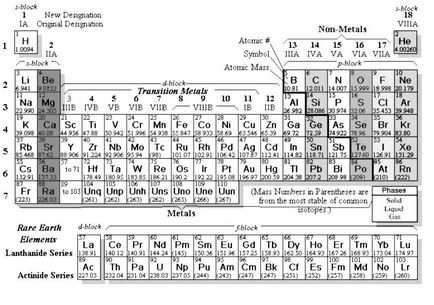
În Rusia, din anumite motive, nu este folosit ....
(Nu acordăm atenție lipsei de culori - în examen puteți obține o versiune alb-negru)
- Nu există subgrupe - există numai grupuri
- Numărul de grupuri este de 18!
- Elementele d sunt între elementele s și p (d-bloc)
- în consecință, nu există rânduri în perioade - trebuie doar să fie eliminate
Acest tabel prezintă secvența electronilor care umple nivelele de energie.
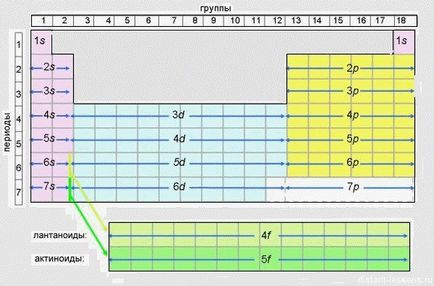
Acest comprimat recomand foarte mult pentru imprimare și utilizare activă în pregătirea examenului. Pe USE, desigur, vi se va da un formular "scurt", dar până atunci va fi mai ușor să navigați.
Deci, odată cu introducerea, ne-am dat seama, hai să ne mutăm direct la subiect ...
Structura cojilor de electroni ai atomilor
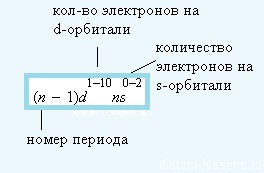
Numărul maxim posibil de electroni pe d-pod este de 10,
Caracteristici de umplere electronică a subsolurilor:
Observați că Sc este primul d-element și că acest d-subsub începe să se umple cu electroni (substratul s este deja plin).
Cr are brusc o "anomalie" - un electron pe s-subsol.
Apoi se declanșează regula Gund:
Mutarea orbitali aparținând aceleiași subnivelul putere începe electroni singure cu paralele (același semn) se rotește și numai după ce electronii singure ocupa toate orbitali pot să apară orbitali finală de sedimentare de electroni în perechi cu spin opus. Ca urmare, spinul total (și suma numerelor cuantice de spin) ale tuturor electronilor din atom vor fi maximali.
Să "traducem": cu cât mai mulți electroni nepermanenți, cu atât mai bine! 🙂
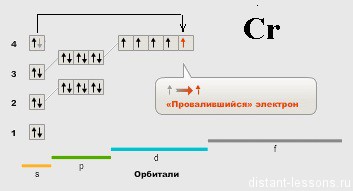
Electronul "cade" de la substratul S, astfel încât electronii neparticipați devin mai mari.
În continuare, totul merge bine - d-orbitalul este umplut sistematic cu electroni.
Pentru Cu și Zn, d-podul este complet umplut (10 electroni). Electronii sunt electroni S-sublevel.
Alte elemente au, de asemenea, un astfel de "eșec".
Următoarele perioade nu vom discuta în detaliu, dau aici o placă cu configurații electronice de elemente d.
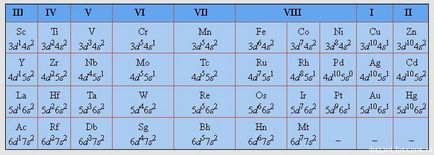
Practica - scrie-ti structura fiecaruia din aceste elemente!
Trimiteți-le prietenilor: