2.15 Hidroliza ca proces de schimb
Știți că, conform teoriei disocierii electrolitice, particulele unei substanțe dizolvate interacționează cu moleculele de apă într-o soluție apoasă. O astfel de interacțiune poate duce la o reacție de hidroliză (din hidro-apa grecească, liza-descompunere, rasyad).
Hidroliza este o reacție a descompunerii schimbului de substanțe cu apă.
Diferite substanțe sunt supuse hidrolizei: săruri anorganice, carburi metalice și hidruri, halogenuri nemetalice; organohalogenați. grăsimi și grăsimi complexe, carbohidrați, proteine, polinucleotide.
Reacțiile de hidroliză pot fi reversibile și ireversibile. Să luăm în considerare diferite cazuri ale acestui proces și semnificația acestuia.
Hidroliza substanțelor organice
1. Hidroliza haloalcanilor este utilizată pentru producerea de alcooli.
Prezența alcalinei (OH) permite "legarea" acidului rezultat și schimbarea echilibrului către formarea alcoolului.
2. Hidroliza esterilor complexi are loc în mod reversibil într-un mediu acid (în prezența unui acid anorganic) pentru a forma alcoolul corespunzător și un acid carboxilic.
Pentru a schimba echilibrul chimic față de produsele de reacție, hidroliza se efectuează în prezența alcalinei.
Punct de vedere istoric, primul exemplu al acestei reacții a fost de scindare alcalină a esterilor acizilor grași superiori, rezultând într-un săpun. Acest lucru sa întâmplat în 1811, când omul de știință francez E. Shevrel. încălzirea grăsimilor cu apă într-un mediu alcalin, obținerea de glicerină și săpunuri - săruri ale acizilor carboxilici mai mari. Pe baza acestui experiment, sa stabilit compoziția grăsimilor, s-au dovedit a fi zfi-ri complexe, dar numai "de trei ori complicate. derivații glicerolului trigliceridic al alcoolului triatomic. O hidroliza esterului proces în mediu alcalin este în continuare denumit „saponificare“ .Naprimer, saponificarea esterului format prin glicerol, palmitic și acid stearic:
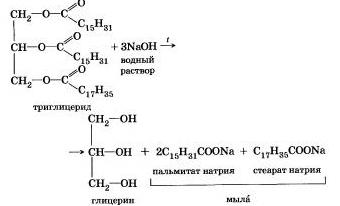
Sărurile de sodiu ale acizilor carboxilici mai mari sunt principalele componente ale săpunului solid, sărurilor de potasiu ale săpunului lichid.
Chimistul francez M. Berthelot în 1854 a efectuat reacția de esterificare și pentru prima dată a sintetizat grăsime. Prin urmare, hidroliza grăsimilor (precum și a altor esteri) este reversibilă. Ecuația de reacție poate fi scrisă ca:
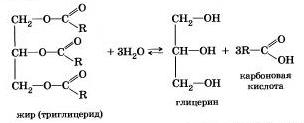
În organismele vii, are loc hidroliza enzimatică a grăsimilor. In intestin, sub influența unei enzime lipaza grăsimi gidratizuyutsya alimentari în glicerol și acizi organici, care sunt absorbite de peretele intestinal și în corpul sintetiza noi grăsimi inerente organismului dat. Acestea intră în sânge prin sistemul limfatic și apoi în țesutul adipos. De aici grăsimile vin în alte organe și țesuturi ale corpului, în care în procesul de metabolism în celulele din nou, și apoi hidrolizat oxidat gradat la bioxid de carbon și apă, cu eliberare de energie necesară pentru viață.
În tehnică, hidroliza grăsimilor este utilizată pentru a produce glicerină, acizi carboxilici mai mari, săpun.
3. După cum știți, carbohidrații sunt cele mai importante componente ale alimentelor noastre. Di- (sucroză, lactoză, maltoză) și polizaharide În condiții de laborator și industriale, un acid este utilizat ca catalizator pentru aceste procese. Reacțiile se efectuează cu încălzire.
Reacția de hidroliză a amidonului la glucoză sub acțiunea catalitică a acidului sulfuric a fost efectuată în 1811 de către cercetătorul rus K. S. Kirchhoff.
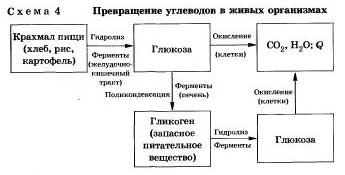
În organismul uman și animale, hidroliza carbohidraților are loc sub acțiunea enzimelor (Schema 4).
Hidroliza industrială a amidonului produce glucoză și melasă (un amestec de dextrine, maltoză și glucoză). Patoku este folosit în produse de cofetărie.
Dextrină ca un produs de hidroliză parțială a amidonului acțiune exponat adeziv: acestea sunt asociate cu apariția de pâine neagră și cartofi prăjiți, precum și formarea unui film dens pe rufe nakralmalennom sub influența unui fier de călcat fierbinte.
O altă polizaharidă cunoscută, celuloza, poate fi de asemenea hidrolizată în glucoză prin încălzire prelungită cu acizi minerali. Procesul este gradual, dar scurt. Acest proces stă la baza multor industrii de hidroliză. Acestea servesc pentru produsele alimentare, hrana pentru animale și nealimentare din vegetația brută tehnic - deșeuri, conectându lemn (rumeguș, așchii), culturi de prelucrare (paie, coji de semințe, tulpini de porumb, etc ...).
Produsele tehnice ale unor astfel de industrii sunt glicerina, etilenglicolul. acizi organici, drojdie furajeră, alcool etilic, sorbitol (alcool hexahidrat).
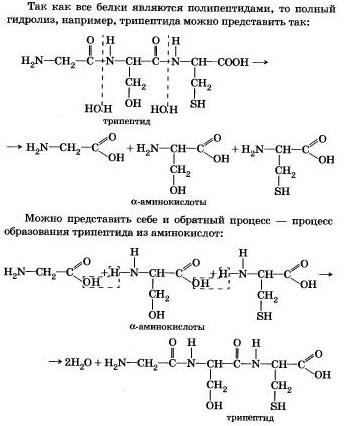
4. Știți că proteinele biopolymer - baza vieții tuturor organismelor vii (de la virus la ființe umane) - constau în principal din aminoacizi (cel mai adesea 20). Stabilirea unei secvențe de reziduuri de aminoacizi care constituie molecula de proteină este obiectivul inițial în studiul structurii sale. Și pentru a stabili aceasta ajută la hidroliza treptată a proteinei, care se efectuează atunci când este încălzită cu acizi sau baze, precum și prin acțiunea enzimelor.
5. Un rol imens de important în organism este jucat de procesul de hidroliză a adenozin trifosfatului (LTP). Această substanță servește ca sursă de energie pentru toate tipurile de reacții biochimice (construirea de proteine, contracția musculară etc.). În timpul hidrolizei ATP la adenozin difosfat (ADP), se eliberează energie.
Procesul invers al formării ATP din ADP are loc cu absorbția energiei. Prin urmare. ATP este substanța energetică universală a celulei.
Soluțiile apoase de săruri au valori diferite ale pH-ului și a diferitelor tipuri de medii - acid (pH <7), щелочную (рН> 7), neutru (pH = 7). Acest lucru se datorează faptului. că sărurile în soluții apoase pot suferi hidroliză.
Esența hidrolizei este redusă la interacțiunea chimică de schimb a cationilor sau a anionilor sării cu moleculele de apă. Ca urmare a acestei interacțiuni, se formează un compus cu disociere scăzută (un electrolit slab). Și în soluția apoasă a sării există un exces de ioni H- sau OH + liberi, iar ruptura de sare devine acidă sau, respectiv, alcalină.
Orice sare poate fi reprezentată ca produs al reacției bazei cu acidul. În funcție de concentrația bazei și acidului, este posibil să se izoleze 4 tipuri de săruri (Schema 6).
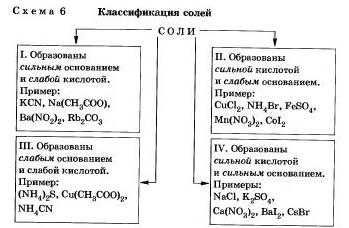
Luați în considerare comportamentul sărurilor de diferite tipuri în soluție
I. Săruri formate dintr-o bază puternică și un acid slab
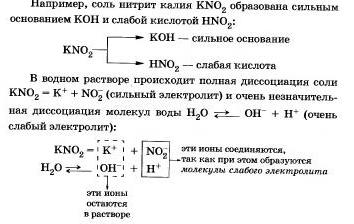
Acest proces este reversibil, echilibrul chimic este deplasat spre stânga (spre formarea substanțelor inițiale), deoarece apa este un electrolit mult mai slab decât acidul azotic.
Ecuația de hidroliză ionică redusă este tinglă că:
a) în soluție este gidroksoiony OH liberă și concentrația lor este mai mare decât în apă pură, astfel încât soluția de sare KN02 are un mediu alcalin (pH> 7);
b) în reacția cu apa, participă anionii N02; în acest caz, ei spun că hidroliza provine de la anion.
Alte exemple de anioni care participă la reacția cu apă sunt:
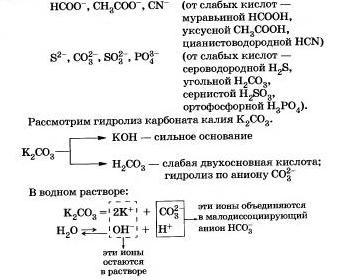
Să rezumăm ceea ce ați învățat despre hidroliza anionului:
a) anionul de sare este de obicei hidrolizat în mod reversibil;
b) echilibrul chimic în astfel de reacții este puternic deplasat spre stânga;
c) reacția mediului în soluții de astfel de săruri este alcalină (pH> 7);
d) hidroliza sărurilor formate din acizi polibazici slabi produce săruri acide.
Săruri formate de un acid puternic și o bază slabă.
De exemplu, luați în considerare hidroliza iodurii de amoniu NH4I.
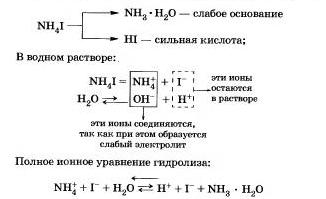
Procesul este reversibil, echilibrul chimic este mutat spre formarea de materii prime, deoarece apa de H20 este un electrolit mult mai slab decât hidratul de amoniac.
Ecuația arată că:
a) în soluție există ioni de hidrogen liber H și concentrația lor este mai mare decât în apa pură, prin urmare soluția de sare are un mediu acid (pH <7);
b) cationii de amoniu participă la reacție cu apă; în acest caz se spune că hidroliza are loc de-a lungul cationului.
În reacția cu apa, pot participa și cationi multipli încărcați: M2 + dublu încărcat. cu excepția cationilor de metale alcalino-pământoase, Me3 + triplu.
Să luăm în considerare hidroliza clorurii de nichel NiCl2.
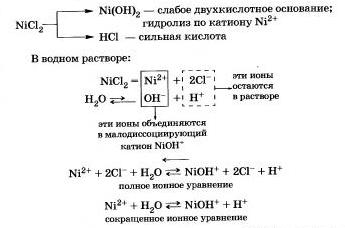
Produsele de hidroliză sunt sarea de bază a Ni0HCl și a acidului clorhidric HCI.
Soluția apoasă de acid clorhidric de nichel (pH <7), потому что в растворе увеличивается концентрация ионов
Hidroliza sarii Ni0HCl se desfasoara intr-o masura mult mai mica si poate fi neglijata.
Să rezumăm ceea ce ați aflat despre hidroliza cationului:
a) prin cationul sării, de regulă hidrolizează reversibil
b) echilibrul chimic al reacțiilor se schimbă spre stânga
III. Săruri formate dintr-o bază slabă și un acid slab.
Este clar pentru voi că este clar că astfel de săruri sunt hidrolizate de cation și de anion.
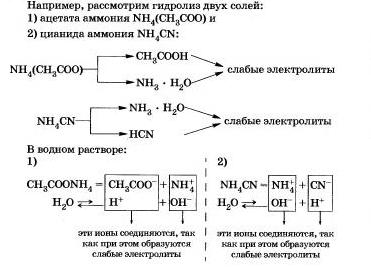
După cum ați observat deja, hidroliza celor mai multe săruri este un proces reversibil. Cu toate acestea, unele săruri sunt complet descompuse de apă, adică hidroliza lor este un proces ireversibil.
concluzii:
a) dacă sărurile sunt hidrolizate și cationizate și anionul este reversibil, echilibrul chimic în reacțiile de hidroliză este deplasat spre dreapta;
b) reacția mediului este fie neutră, fie slab acidă sau ușor alcalină, în funcție de raportul dintre constantele de disociere ale bazei și acidul format;
c) sărurile pot hidroliza atât pe cation cât și pe anion ireversibil dacă cel puțin unul dintre produsele de hidroliză părăsește sfera de reacție.
IV. Sărurile formate de o bază puternică și un acid puternic nu sunt supuse hidrolizei. Ați ajuns, evident, la această concluzie.
Luați în considerare "comportamentul" într-o soluție de clorură de potasiu KCI.
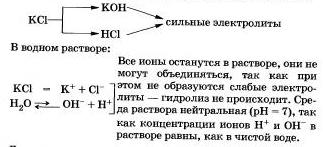
Alte exemple de astfel de săruri includ nitrați, perclorați, sulfați, cromit și dicromați ai metalelor alcaline, halogenuri (cu excepția fluorurilor), nitrați și perclorați ai metalelor alcalino-pământoase.
Rezumăm informația privind hidroliza sărurilor din Tabelul 14. De asemenea, trebuie remarcat faptul că reacțiile de hidroliză reversibilă sunt complet supuse principiului Le Chatelier. Prin urmare, hidroliza sării poate fi intensificată (și chiar ireversibilă) în următoarele moduri:
a) adăugați apă (reduceți concentrația);
b) încălzirea soluției, în timp ce disocierea endotermică a apei este intensificată și, prin urmare, crește numărul de ioni de H și OH. care sunt necesare pentru hidroliza sarii;

c) leagă unul dintre produsele de hidroliză într-un compus slab solubil sau îndepărtează unul din produse în faza gazoasă; de exemplu, hidroliza cianurii de amoniu va fi mult îmbunătățită prin descompunerea amoniacului hidrat pentru a forma amoniac și apă.
Hidroliza poate fi suprimată (reducând semnificativ cantitatea de sare hidrolizată:
a) creșterea concentrației de substanță dizolvată
b) răcirea soluției;
a) introduc în soluție unul dintre produsele de hidroliză; de exemplu, se acidulează soluția dacă reacția sa ca urmare a hidrolizei este acidă sau este alcalinizată, dacă este alcalină.
Hidroliza sărurilor are o semnificație practică și biologică
În cele mai vechi timpuri, cenușa a fost utilizată ca detergent. Cenușa conține carbonat de potasiu, care în apă este hidrolizat de către anion, soluția apoasă dobândește o ușoară datorită ionilor de OH formați în timpul hidrolizei.
În prezent, în viața de zi cu zi, folosim săpun, pulberi de spălat și alte detergenți. Componenta principală a săpunului este sărurile de sodiu sau potasiu ale acizilor carboxilici grași mai mari: stearați, palmitați, care sunt hidrolizați.
În acești detergenți și alți detergenți, sunt introduse în mod special săruri ale acizilor anorganici (fosfați, carbonați), care sporesc detergența prin creșterea pH-ului mediului.
Sărurile care creează mediul de soluție alcalină necesară sunt conținute de dezvoltatorul fotografic. Acesta este carbonatul de sodiu, carbonatul de potasiu, boraxul și alte săruri hidrolizate, dar anion.
Dacă aciditatea solului este inadecvată, plantele au o boală - cloroză. Semnele sale sunt îngălbenirea sau albirea frunzelor, un decalaj în creștere și dezvoltare. Dacă pH-ul este mai mare de 7,5, se adaugă sulfat de amoniu în îngrășământ, care promovează aciditatea datorită hidrolizei cationului care trece prin sol. Rolul biologic al hidrolizei anumitor săruri care alcătuiesc corpul nu este apreciat.
Rețineți că în toate reacțiile de hidroliză stările de oxidare ale elementelor chimice nu se modifică. Reacțiile de oxidare-reducere la reacțiile de hidroliză nu sunt de obicei luate în considerare, deși apare interacțiunea substanței cu apa.
1. Alegeți exemple de substanțe organice care se supun hidrolizei:
glucoză, etanol, bromometan, metanal, zaharoză, ester metilic al acidului formic, acid stearic, 2-metilbutan.
Scrieți ecuațiile reacțiilor de hidroliză; în cazul hidrolizei reversibile, specificați condițiile care permit deplasarea echilibrului chimic spre formarea produsului de reacție.
2. Care săruri sunt supuse hidrolizei? Ce fel de mediu pot avea soluțiile apoase de săruri? Dați exemple.
3. Care săruri sunt hidrolizate de cation? Scrieți ecuațiile pentru hidroliza lor, specificați mediul.
4. Care dintre sărurile supuse hidrolizei prin anion?
5 *. Adăugarea uneia dintre următoarele substanțe la soluția de clorură ferică (III) va îmbunătăți hidroliza sării: HCI, NaOH, ZnCl2, Dă-mi o explicație.
6. Propune metode de suprimare a hidrolizei unei soluții apoase de sulfură de potasiu.
Articole similare
-
Prezentare pe tema laboratoarelor digitale - Archimedes - în studiul fizicii, biologiei, chimiei,
-
Schimbul de proteine, grăsimi și carbohidrați în organism - biologie în întrebări și răspunsuri
Trimiteți-le prietenilor: