Chiar și în Evul Mediu, chimistul a atras atenția asupra faptului că unele elemente chimice sunt similare unul cu celălalt într-o serie de proprietăți și în compoziția compușilor formați de ei. Treptat de la toate seturile de elemente a fost posibilă alocarea familiilor naturale. care combină elementele conexe. Acestea au fost, de exemplu, o familie de metale alcaline și o familie de halogeni. În secolul al XIX-lea s-au descoperit noi regularități în proprietățile elementelor, iar chimiștii au început să încerce să unească toate elementele cunoscute într-un singur sistem.
serie naturală de elemente chimice în care sunt ordonate prin creșterea numărului atomic Z, marele om de știință a fost în măsură să obțină de la valorile ponderilor atomice ale elementelor, care, în această serie, de asemenea, tind să crească. Pe baza periodicității proprietăților observate în seriile naturale, DI Mendeleev a formulat o lege periodică și a finalizat sistematizarea elementelor. Formularea legii modernă periodică, după cum urmează: „Proprietățile elementelor chimice și compoziția lor și proprietățile compușilor sunt periodice în funcție de sarcina de nucleele atomice.“
Geniul de deschidere Mendeleev este că oamenii de știință au reușit să prindă relația naturală a numărului și chimice atomice proprietăți, fără nici o posibilitate de a explica, deoarece nu există nimic în momentul în care nu a fost conștient de nucleul atomic sau un coji de electroni, sau despre electronii de valență.
Astfel sa născut un sistem periodic de elemente chimice. acoperind și sistematizând toate elementele fără excepție. Există o mulțime de variante de afișare grafică a acestui sistem, dar cea mai comună este varianta tabulară. Aspectul său modern este prezentat în figura următoare.
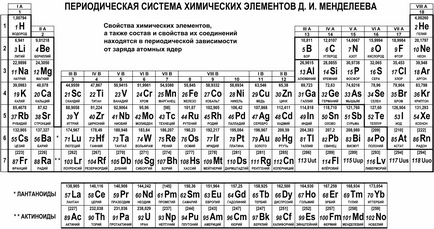
serie naturală de elemente chimice din tabelul periodic este situat în șapte rânduri orizontale, numite perioade și sunt numerotate de la 1 la 7 (lantanide și actinide aparțin perioadei a șasea și a șaptea, respectiv, și furnizate în linii separate din motive de comoditate). Primele trei perioade sunt numite mici. deoarece conțin un număr mic de elemente (2 sau 8); perioadele rămase sunt numite mari. deoarece în fiecare dintre ele se află un număr mare de elemente (18 sau 32).
Familiile naturale ale elementelor se dovedesc a fi situate în coloanele verticale ale grupurilor de tabele. Pe lângă grupurile de numerotare prin numerele 1, prin 18, desemnarea prin cifre romane I la VIII și literele A (principal) sau B (o parte). De exemplu, familia de metale alcaline (Li, Na, K, Rb, Cs, Fr) este în grupul IA, și așa-numitele metale de monedă (Cu, Ag, Au) - în grupa IB; familie de halogeni (F, CI, Br, I, At) aparține unui grup VIIA și gaze nobile (He, Ne, Ar, Kr, Xe, Rn) aparțin grupului VIIIA.
Este interesant să știți! Versiunea originală a tabelului de elemente a inclus jumătate din numărul de elemente, iar unele dintre ele au fost plasate într-un mod diferit. Odată cu descoperirea unor elemente noi si dezvoltarea de idei despre structura atomilor și a sistemului periodic al rafinat evoluat, iar această poveste are o mulțime de mistere și descoperiri. Chiar și acum situația anumitor elemente din sistem continuă să fie specificat: de exemplu, familiile lantanide și actinide se face referire în mod tradițional la grupa IIIB cu lutețiu (Lu) și lawrenciu (Lr), ci direct pe o coloană IIIB în schimb Lu și Lr sunt lăsate să respectiv lantan (La ) și actiniu (Ac).
Doar o jumătate de secol după descoperirea legii periodice, oamenii de știință au reușit să arunce o lumină asupra structurii interne a atomului și să explice periodicitatea în proprietățile elementelor. Datorită succeselor fizicii fundamentale, știm acum că cauza legii periodice este structura stratificată a coajelor de electroni ale atomilor.
În seria naturală de elemente chimice, sarcina nucleului Z și, prin urmare, numărul de electroni din atom, crește consecutiv. În acest caz, în norul de electroni se formează straturi care sunt umplute succesiv cu acești electroni. După ce se acumulează opt electroni pe stratul exterior (și doi pentru primul strat), stratul următor începe să se umple și deja devine extern. Astfel, scenariul de umplere a stratului exterior se repetă periodic. și din moment ce electronii stratului exterior sunt valență, atât proprietățile chimice, cât și compoziția compușilor se repetă periodic cu creșterea Z.
De îndată ce stratul următor începe să se umple cu electroni, în tabelul Mendeleyev mergem la următoarea linie, adică în perioada următoare. Prin urmare, numărul perioadei în care este localizat elementul este egal cu numărul de straturi de electroni din atomul acestui element și coincide cu numărul stratului de electron extern. De exemplu, în elementele primei perioade (H, He), electronii formează numai primul strat; pentru elementele celei de-a doua perioade (Li, Be, B, C, N, O, F, Ne) ele formează două straturi, dintre care exteriorul este al doilea; și așa mai departe.
În acest grup, în acest grup intră elemente cu același număr de electroni de valență. Pentru elementele grupele A-valent sunt doar electronii din stratul exterior, iar numărul lor crește la unul la opt în fiecare perioadă (cu excepția primei). De aceea, grupele A-numerice (desemnate cu cifre romane) în care elementul este egal cu numărul de electroni per atom în stratul exterior al elementului. Singura excepție de la această regulă este heliu: atom doar cu doi electroni în stratul exterior, dar acesta este plasat într-un grup VUIA, deoarece stratul exterior umplut conferă proprietățile unui heliu gaz nobil.
Sistematizând elementele, DI Mendeleev a respins în principal din compoziția și proprietățile substanțelor și compușilor simpli cu oxigen și hidrogen. Acești compuși caracterizează în mare măsură natura elementului, așa că sunt adesea numiți compuși caracteristici. Ele sunt denumite în mod tradițional oxizi, hidroxizi și compuși de hidrogen. Folosind a treia perioadă ca exemplu, putem vedea cum numărul de electroni de valență afectează compoziția și proprietățile acestor compuși (argonul nu le formează și, prin urmare, nu este inclus în tabel):
Articole similare
Trimiteți-le prietenilor: