1 Scopul muncii
Scopul este de a studia natura activității de disociere și ch-cal a diferitelor tipuri de electroliți, care determină reacții de direcție ment în soluții de electroliți, condițiile de cercetare Dropped Denia precipitare și dizolvare.
2 Prevederi teoretice de bază
2.1 Electroliți puternici și slabi. Constanta si gradul de disociere
Electroliții sunt substanțe ale căror soluții sau topiri conduc curent electric.
Purtătorii de curent în soluțiile de electroliți sunt ioni, care se formează ca urmare a disocierii substanței dizolvate.
Disocierea electrolitică este degradarea compușilor ionici sau polari în ioni sub acțiunea moleculelor polare ale solventului.
Prin capacitatea de a disocia, toate substanțele sunt împărțite în două grupe: una include substanțele care disociază în soluție, fie complet sau aproape complet; unui alt grup sunt substanțe care disociază în parte.
Substanțele care se disociază aproape complet în ioni sunt denumite electroliți puternici.
Substanțele care disociază în soluții nu sunt complet numite electroliți slabi. În soluțiile de electroliți slabi, se stabilește un echilibru dinamic între molecule nedisociate și ioni:
Acest echilibru este caracterizat cantitativ de o constantă a echilibrului, care, în ceea ce privește procesul de disociere, se numește constanta de disociere:
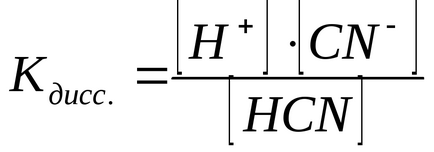
Condiția de disociere a electrolitului este independentă de concentrația soluției, dar depinde de temperatura acesteia, precum și de natura substanței dizolvate și a solventului. Cu cât valoarea constantei este mai mică, cu atât electrolitul este mai slab.
Astfel, diferența fundamentală dintre cele două tipuri de electroliți este disocierea ireversibil de electroliți puternici și disocierea reversibilitatea electroliți slabi.
Caracteristica cantitativă a capacității unui electrolit de a se descompune în ioni este gradul de disociere - . Gradul de disociere a electrolitului este raportul dintre numărul de molecule sale în soluția putrezite ionilor din electrolit la numărul total de molecule în soluție. Gradul de disociere a electrolitului în 0,1N. soluția este luată ca un criteriu pentru atribuirea electrolitului la grupul de electroliți puternici sau slabi pentru electroliți puternici > 0,3, electroliți slab ≤ 0,03.
În ceea ce privește soluțiile apoase de electroliți puternici sunt:
- baze puternice: hidroxizi ai metalelor alcaline și alcalino-pământoase:
- cele mai solide săruri. Excepții: Fe (SCN) 3. Mg (CN) 2. HgCl2. Hg (CN) 2 și altele.
Electroliții slabi sunt:
- baze slabe și hidroxizi metalici amfoterici: Be (OH) 2. Mg (OH) 2. Fe (OH) 2. Zn (OH) 2. hidroxid de amoniu NH4OH, precum și baze organice - amine (CH3NH2) și amfoliți (H3N + CH2COO-);
- un electrolit foarte slab este apa (H2O), = 2 · 10-9.
În cazul electrolitei AX, se disociază în ionii A + și X -. constanta și gradul de disociere sunt legate de relația dintre legea de diluare a lui Ostwald:
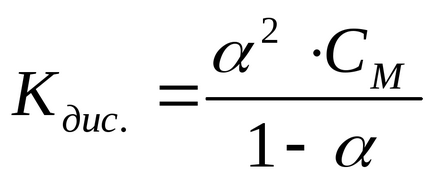
Cm este concentrația molară a electrolitului, mol / l.
Dacă gradul de disociere este mult mai mic decât unitatea, atunci cu calcule aproximative se poate presupune că 1 -

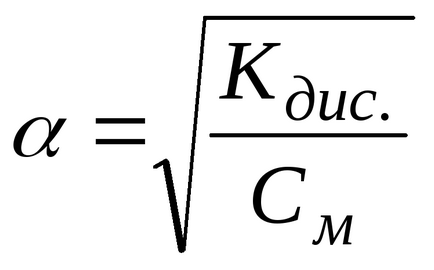
Ultima ecuație arată că atunci când soluția este diluată, adică Cu o scădere a concentrației de electroliți (CM), gradul de disociere a electrolitului crește.
Trimiteți-le prietenilor: