
epigraf
Și voi fi ca o molie pentru Efraim.
Cartea lui Osea 5:12
Cunoscând greutatea moleculară a substanței și molaritatea soluției, este posibil să se calculeze cantitatea de substanță dizolvată și fracția de masă a substanței dizolvate.
Masa atomilor pentru calculul greutății moleculare a substanței dizolvate poate fi văzută în tabelul periodic din partea de jos a paginii (numărul sub simbolul elementului)
În cazurile practice, molaritatea soluției are ca rezultat unități multiple (sau mai multe) - milli, nano etc.
Mole este o unitate pentru măsurarea cantității unei substanțe, numele depășit este o moleculă gram. Mole este una dintre cele șapte unități de bază ale sistemului SI. Formula exactă a conceptului de "mole" este după cum urmează:
Mole este cantitatea unei substanțe într-un sistem care conține cât mai multe elemente structurale ca atomii în carbon-12 cu o masă de 0,012 kg. Atunci când se utilizează un mol, elementele structurale trebuie specificate și pot fi atomi, molecule, ioni, electroni și alte particule sau grupuri de particule specificate.
Numărul elementelor structurale specificate într-un mol de substanță se numește numărul Avogadro. Numărul Avogadro este de aproximativ 6.022 × 10 23 mol -1
Din cele de mai sus rezultă că masa molară carbon-12 este de 12 g / mol. Aparținând molecula pentru a determina masa molară a unei substanțe ar trebui să calculeze greutatea moleculară, care este egală cu suma maselor atomice. Acest lucru se poate realiza folosind date din nablitsy Mendeleev (partea de jos a paginii) De exemplu, sarea NaCl atomul greutate sodiu este 22,99, greutatea atomilor de clor - 35,453, o greutate moleculară totală este de aproximativ 22,99 + 35,45 = 58,44, iar masa molară, respectiv, 58,44 g / mol. este necesară masa molara pentru a calcula conținutul de substanțe în soluții, concentrația care este dat sub formă de soluție molaritate.
Molar - (molaritatea) concentrația soluției, exprimată ca greutate (în grame) a unui solut conținută într-un litru de soluție în raport cu greutatea sa moleculară (altfel molaritate este numărul de moli conținute într-un litru de soluție)
MOLALITATE - (molitatea) număr de moli de substanță dizolvată în 1000 g de solvent. Măsurată în moli pe kg, expresia "în molalitate" este de asemenea comună. Astfel, o soluție cu o concentrație de 0,5 mol / kg se numește 0,5 molar.
În ciuda similarității numelor, concentrația molară și molitatea sunt diferite. Spre deosebire de concentrația molară, la calcularea concentrației în molalitate, calculul se bazează pe masa solventului și nu pe volumul soluției. Din acest motiv, molalitatea nu depinde de temperatură.
De exemplu, conform definiției, o soluție monomolară de clorură de sodiu NaCI este o soluție, 1 litru din care conține 1 mol (și așa cum deja am calculat, 58,44 grame) de NaCI. În consecință, soluția de 0,1 molar va conține în litru 5,844 g de NaCI. Deseori, molaritatea este marcată ca soluție molară M-1M-1, soluție molară 0,1 M-0,1 și așa mai departe.
În practică, trebuie să utilizați cererea, să calculați masa necesară a substanței dizolvate, să o cântăriți și apoi să o dizolvați într-un volum de solvent, puțin mai mic decât cantitatea necesară de soluție. Când dizolvarea este completă, aduceți volumul la valoarea dorită.
De exemplu, doriți să obțineți 450 ml soluție 1M de NaCI în apă. Substituim greutatea moleculară 58,44, molaritatea 1 și volumul de 450 ml în aplicație. Cererea va calcula că aveți nevoie de 26,298 g de sare. Se toarnă aproximativ 400 ml de apă, se dizolvă 26,3 g de sare și se aduce volumul la 450 ml. Inițial, se dizolvă într-un volum mai mic de solvent, deoarece substanța dizolvată ocupă un anumit volum.
Un alt caz. Trebuie să preparați 40 de grame de soluție de NaCl 0,1 moli. Din definiția molalității rezultă că sunt necesare 5 kg de NaCl per kg de solvent. Să presupunem că 40 g din soluție necesită X grame de NaCl. Apoi solventul va avea nevoie de grame (40-X). Să compunem proporția și să o rezolvăm cu privire la X necunoscut. Obținem X = 40 * 0.1 * 58.44 / 1000 = 0.2324. Prin urmare, pentru a obține 40 g de NaCI 0,1 molar, 0,2324 g de sare este dizolvată în 40-0,2324 = 39,7676 g solvent.
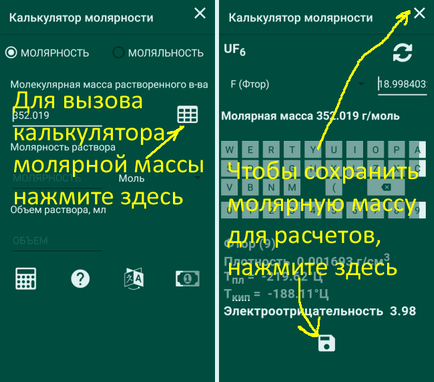
Cum se calculează masa molară
Pentru a calcula masa molară, faceți clic pe "Tabel". În cazul în care calculul este finalizată, faceți clic pe butonul „Save“ (arată ca o dischetă, cine știe ce este), în partea de jos a ecranului sau „Close“, în colțul din dreapta sus sau Androil sistemic „spate“ buton, iar aplicația va aminti rezultatul.
De exemplu, trebuie să calculam masa molară de Ca (OH) 2 de var hidratat
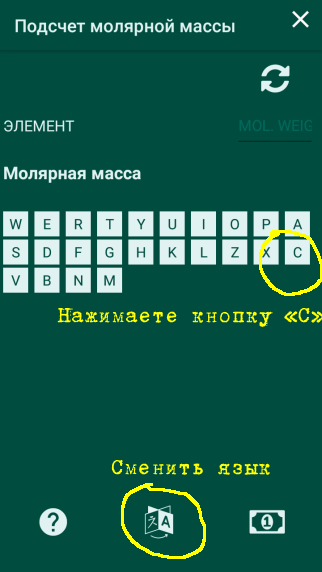
Apăsați tasta cu prima literă a simbolului chimic al calciului - în acest caz, "C". Programul va genera o listă a tuturor elementelor chimice al căror simbol începe cu "C" (de exemplu carbon, cadmiu etc.)

Din listă alegeți calciu. Programul îl afișează în partea superioară a ecranului și afișează diferite caracteristici ale calciului. În centrul ecranului apare inscripția "Masă molară XXX g / mol" în care, surprinzător, masa molară

Puteți modifica greutatea moleculară a elementului, de exemplu, îl puteți schimba de la uraniu de la tabelul 238.0289 la 235. Schimbarea va avea loc într-adevăr în timpul sesiunii curente.
Repetăm procedura până când introducem întreaga formulă a substanței.


Trimiteți-le prietenilor: