Etapa finală a cascadei de coagulare în plasmă este formarea fibrinului insolubil din fibrina proteică plasmatică solubilă sub influența trombinei și f. XIII (figura 42).
Fig. 42. Etapele succesive ale formării fibrinului neselectiv din fibrinogenul solubil
Trombina este enzima cheie a hemostazei. Trombina - o proteină dependentă de vitamina-K - este o serin protează. În ficat, precursorul de protrombină inactiv este sintetizat, care apoi circulă în plasmă. În complexul H. Ha-Va-II pe suprafața fosfolipidică există o proteoliză limitată a protrombinei. Mai multe structuri active cu o masă moleculară descrescătoare, mezotrombin, # 945; -trombină, - trombină, # 947; - trombină. Cel mai important produs este serin proteaza - # 945; - trombină. La
există cel puțin 4 situsuri de legare pentru substraturi, inhibitori, co-factori și ioni de calciu. Acest lucru, precum și capacitatea trombinei de a funcționa în mod activ nu numai pe faza solidă, ci și în fluxul sanguin îi permite să îndeplinească numeroase funcții. Cele mai importante funcții ale trombinei în hemostază:
• Proteoliza limitată a fibrinogenului înainte
fibrom-monomeri (apare într-un lichid
faza-fluxul sanguin).
• Activarea f. V, -VIII, -VII, -XI.
• În combinație cu trombomodulină, trombină
activează proteina C.
• proteoliza limitată a plasmei
carboxipeptidaza B în forma activă -
trombina-activat fibro-
rinoliză (TAFI).
• Stimularea ejecției din endoteliocitele tisulare
un activator de plasminogen.
Cu toate acestea, rolul trombinei în organism nu este limitat.
funcțiile de mai sus.
Un rol cheie în procesul de coagulare a sângelui,
vascular endothelial activation, celular
procesele de creștere și reparare, activarea periferică
celulele sanguine, activarea fibrinoli-
sunt cele mai studiate funcții ale trombilor
pe. Aparent, în timp, această listă este semnificativă.
dar va crește.
Proteine plasmatice de hemostază
O confirmare indirectă a importanței trombina pentru organism poate fi faptul că știm doar câteva descrieri ale pacienților cu molecula defect de trombină homozigotă, iar pacienții cu gipoprotrombinemiey sunt extrem de rare.
Cel mai important inhibitor al trombinei este antitrombina III. Un rol mai mic este jucat de cofactorul heparinei P.
Factorul XIII - transglutaminaza. În plasmă, cea mai mare parte din faza XIII inactivă este asociată cu fibrogenogen. Activarea are loc prin f.HIII og proteoliza marginire inactivi f.HIII Trom-bean simultan cu clivajul peptidei A de fibrinogen. Ca cele mai multe alte enzime, acesta îndeplinește mai multe funcții în hemostază:
• Stabilizează cheagul de fibrină prin
formarea de legături covalente între y-
de monomeri ai fibrinei.
• Participă la legarea, # 945; - inhibitor al plasmei
mina cu fibrina, care contribuie la
eliberarea precoce a fibrino-
cheag Vågå.
• Rolul semnificativ al FHIII joacă în procesul de
polimerizarea actinei, miozinei și altele
componente ale citoscheletului de plachete care
Este extrem de important pentru activarea trombo-
citoză și retragerea fibrin-
nou cheag. Aceasta explică prezența F.XIII
în citoplasma trombocitelor.
• Reacțiile încrucișate din f. XIII cu
v. proteina von Willebrand.
În plus față de reacțiile imediate ale hemostazei,
f.XIII participă la procesele de formare a țesutului conjunctiv, reacții reparative:
• Participă la legarea fibronec-
între ele și cu molecule de fibrină.
Acest lucru este probabil important pentru un regizor
celule și procese de reparații.
• joacă un rol în biosinteza colagenului, catalitic
formarea de legături între molecule
Tipurile de colagen I, II, III și V.
sânge și formează o structură volumetrică puternică care închide efectiv deteriorarea vasului și previne pierderea de sânge. Concentrarea fibrinogenului în sângele unei persoane sănătoase este mult mai mare decât concentrația altor proteine de hemostază, datorită rolului său unic.
Sinteza fibrinogenului are loc în ficat și nu depinde de vitamina K. Un fibrinogen este sintetizat în megacariocite și este conținut în trombocite. Acest fibrinogen este oarecum diferit de fibrinogen, sintetizat în ficat.
În plus față de hepatocite și megacariocite, activitatea genei - lanțurile de fibrinogen găsite în alte țesuturi - creierul, plămânii, măduva osoasă, unde Lanțurile de fibrinogen, aparent, acționează ca molecule de adeziune.
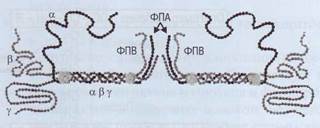
Fibrinogenul - mari multi-proteine, care este format din trei perechi de polipeptide lanțuri TION - 2 # 945;, 2 # 946;, 2 # 947;, legate prin punți disulfidice și legate între ele (Figura 43.).
Structura spațială a moleculei de fibrinogen constă dintr-o centrală E-house-on și 2 domenii D periferice. # 945; - și - lanțurile formează structuri globulare - fibrinele-peptide A și B (FPA și FPV) care închid site-urile complementare în fibrinogen și nu permit acestei molecule să polimerizeze. Procesul de interacțiune a fibrinogenului și a trombinei are loc în faza lichidă - fluxul sanguin. Trombina se leagă de fibrinogen și scindează secvențele finale # 945; - și # 946; -tepi-2 FPA și 2 FPV (figura 44). format PA-
Formarea unui trombus hemostatic
Fibrinogenul este o moleculă unică care are proprietatea de a polimeriza rapid într-un curent
Fig. 43. Fibrinogenul constă din 3 molecule de proteine asociate # 945; # 946; și Fibrinopeptidele A și B (FPA și FPV) sunt scindate cu trombină din fibrinogen, inițiind astfel un proces de polimerizare și transformând fibrinogenul în fibrină
Proteine plasmatice de hemostază
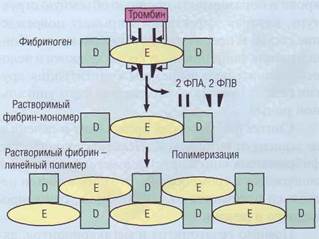
Fig. 44. Formarea monomerilor de fibrină din fibrilă. Trombina scindează fibrinopeptide din APF și molecula FPV de fibrinogen, coloidală astfel format - monomeri de fibrină solubili, care sunt capabile de polimer la somează polimer liniar sau „fibrină solubilă“
a produs monomeri de fibrină. În viitor, se va realiza unirea spontană a siturilor monomerului fibrin complementar. Mai întâi, se formează dimeri, apoi se colectează oligomeri și, în final, fibrina polimerizată monofilamentată. Astfel, circuitul de fibrină-wai format spontan, polimerizarea end-to-end de monomeri de fibrină, în care porțiunea de capăt a unui monomer, interacțiunea factorilor reciproc cu partea centrală a unui alt monomer în situsul ACE clivaj. Rezultatul acestei polimerizări este o polimerie liniară de 2 molecule în lățime (Figura 44). În acest stadiu, fibrina este ușor solubilă în 5-molar
uree, așa că se numește fibrin solubil.
Combinând cu fibrinogenul, trombina nu numai că scindează fibrinopeptidele. dar, de asemenea, activează factorul XIII asociat cu acesta. Factorul XIIIa formează legături covalente între # 947 (casele D) ale filamentelor fibrin solubile (Figura 45), care sunt legate prin formarea de punți peptidice între radicalii laterali ai lizinei și glutaminei. Monofilamentele monocomponente de fibrină formează o rețea puternică, mai puțin susceptibile la fibrinoliză și mai rezistente la influențele mecanice. În această formă, fibrozina nu este solubilă în ureea 5-molară și se numește fibrină insolubilă.
Fig. 46. Un trombus organizat, în care celulele sanguine sunt incluse în rețeaua fibrină
Cheagul fibrinic format este o rețea moleculară tridimensională, în care sunt incluse plachetele, eritrocitele și leucocitele (Figura 46). Trombocitele activate asociate cu filamentele fibrinei prin receptorii GPIIb-IIIa,
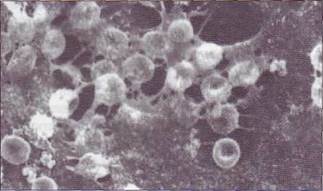
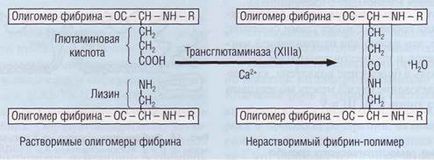
Fig. 45. Formarea fibrinilor insolubili sub influența factorului XIIIa
Proteine plasmatice de hemostază
Xia sub trombostenina (plachetar actomiozin th), datorită proprietăților lor kontrak-treierat inerente (vezi. „Trombocite“ secțiune). Pro-vine o retragere a cheagului de sânge. Cheagul este compactat, o parte a serului este stoarsă din el. Formarea trombului final are loc în 10-15 minute după polimerizarea fibrinului.
Dacă trombocitele sunt absente sau au un defect GPIIb-IIIa, retragerea cheagului de sânge nu apare și este rapid lizată în procesul de fibrinoliză. În absența retragerii trombului în patul vascular, este posibilă separarea masei trombotice și a embolismului vaselor îndepărtate (tromboembolism).
Trimiteți-le prietenilor: