Electroliti. Acumulatorii de plumb sunt umpluți cu electroliți, care constau din baterii de acid sulfuric și apă distilată. Acidul sulfuric reîncărcabil este un lichid uleios transparent, greu, care se dizolvă bine în apă, inodor, corodează pielea, hârtia, materia. Se prepară trei tipuri de acid sulfuric pentru prepararea electrolitului: semnul de calitate, clasa I și clasa a II-a. În acidul sulfuric de gradul I și 2 la limitele admise, numărul de impurități (fier, oxizi de azot, arsenic, mangan, etc.) este redus. Acidul sulfuric reîncărcabil vine de la fabrici în sticle de sticlă cu dopuri din sticlă de sticlă, din polietilenă sau din plastic. Sticlele sunt instalate în coșuri de salcie, din polietilenă sau din lemn. Acestea trebuie să fie purtate de doi lucrători, cu respectarea strictă a regulilor de siguranță.
Apa distilată diferă de apa de la robinet sau de râu aproape complet absența impurităților (săruri, sulfați, cloruri, etc.). Astfel de apă este obținută prin cuburi de distilare - distilatori.
Electrolitul este preparat într-un recipient curat, rezistent la acizi (ebonită, ceramică, faianță). Deseori folosiți rezervoare din lemn, în interiorul căptușite cu plumb. Nu utilizați obiecte din sticlă: când se dizolvă acid sulfuric, se eliberează o cantitate mare de căldură, iar vasele de sticlă încălzite pot exploda.
Vasul a fost turnat apă distilată și apoi cu acid sulfuric într-un curent subțire, în timp ce sub agitare această baghetă soluție de sticlă sau de ebonită Deoarece acidul sulfuric este mai greu decât apa, căldura degajată în timpul dizolvării este distribuit uniform în electrolit. Nu vărsați apă în acid. În acest caz, jetul de apă care intră în contact doar cu acidul straturi de suprafață este încălzită rapid și stropite cu acid sulfuric Aceste particule stropii cad pe piele poate provoca arsuri grave. La pregătirea electrolitul, purtați ochelari de protecție, mănuși de cauciuc și șorț, salopete cârpă și galoșii. Pentru neutralizarea electrolitul acid sulfuric este prins pe piele sau haine, trebuie să fie întotdeauna o soluție de sodă 5-10% sau o soluție de amoniac putere de 5-10%. Dacă acidul sulfuric intra in piele, ar trebui să fie imediat umeziți soluția protectoare și apoi de câteva ori cu apă. Hidrometrul masurat densitatea de electrolit (Figura 211, a) este un tub de sticlă 4, etanșat pe ambele părți, partea de jos care există o sinker, iar la partea superioară - scara Hydrometer A coborât în paharul 1 cu un electrolit 2, într-o poziție verticală, în care o parte din acesta iese în afară Adâncimea de imersie a hipermetrului depinde de densitatea electrolitului:
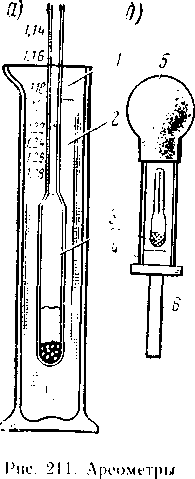
mai mare decât densitatea electrolitului, cu atât mai puțin este imersat Prin divizare scară hidrometru, care este situat la nivelul soluției determină densitatea areometrului electrolit fără fir (Figura 211, b) este plasat într-un tub de sticlă 4, la un capăt al căreia este montat un bec de cauciuc 5, iar pe celălalt Hollow vârful 6 dintr-un material rezistent la acizi, cu un electrolit bec de cauciuc este aspirat într-un tub de sticlă cu un hidrometru. Pentru a umple bateriile noi cu plumb acid staționare utilizați o densitate electrolit de 1,18 g cm3 la o temperatură de 25 ° C cu creșterea densității electrolitului de 1.18-1.29 gem 3 scade temperatura de congelare, de exemplu, densitatea electrolitului 1,29 g / cm 3 ingheata la Temperatura de -74 C. prin urmare, bateriile portabile, care funcționează la temperaturi scăzute, se toarnă un electrolit de densitate ridicată, de exemplu, în zonele centrale, la o temperatură în timpul iernii pentru a -ZO bateriile C. starterului electrolit este turnat densitate de 1,27 g / cm 3 baterii Tipo ABN, ABN 72 și 80 este umplut cu densitate electrolit de 1,21 g cm3 înainte de umplerea nevoilor baterie cu electrolit /), răcită la o temperatură de 25 ° C Pentru a reduce timpul de răcire, se recomandă preparare electrolit în trepte: acid cu densitate 1,83 g cm3, pregăti densitatea electrolitului de 1,4 unui heme 3, ea - - electrolit densitate 1,18-1,3 g cm3
Procese chimice. Într-o masă activă baterie plumb încărcată a plăcilor pozitive este dioxidul de plumb din R02. și negativ - al plumb spongios Pb dioxid de plumb are o culoare maro închis și plumbul spongios - plăci de culoare gri deschis cufundat într-un electrolit - soluție apoasă de acid sulfuric rezultând disocierea electrolitică a unei molecule de electrolit acid sulfuric este divizat în ioni pozitivi de hidrogen și ioni negativi de reziduuri de acid
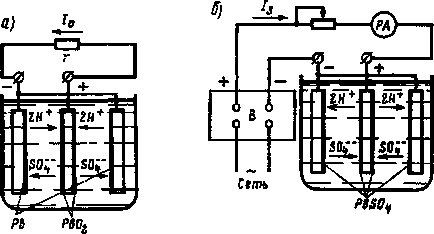
Pentru a atașa bateria încărcată energie rezistență receptor r (Figura 212, precum și), și ia în considerare procesele chimice din acumulatorul în timpul descărcării acestuia, descărcarea curentă 1. dirijată din placa pozitivă prin intermediul receptorului de energie g la plăcile negative, iar apoi prin electrolit - de la pozitiv la plăcile negative,
În electrolit, ionii pozitivi ai hidrogenului 2H + se deplasează în direcția curentului, iar ionii negativi ai GOR - - împotrivă Ca rezultat al descărcării în acumulatorul de plumb, apar reacții chimice
Se poate observa din ecuație că, în procesul de descărcare, dioxidul de plumb este PbO. la plăcile pozitive și burete plumb Pb la plăcile negative, sunt transformate în plumb sulfat + RYAO Aceste reacții chimice au loc cu absorbția de acid sulfuric, astfel încât în electrolit procesului densității de descărcare este redusă. La o deversare profundă, sulfatul de plumb se transformă într-o sare solidă, grosieră cristalină, care este redusă puțin în timpul încărcării. Prin urmare, bateriile sunt descărcate numai la o anumită densitate a electrolitului. Pentru baterii staționare este 1,17- 1,15 g / cm 3. Pentru a încărca bateria prin curentul continuu este trecut, oppositely dirijat curent de evacuare. Pentru aceasta, bateria este conectată la redresorul B (Figura 212, b) sau la o altă sursă de curent continuu. Terminalul pozitiv al redresorului este conectat la blocul de plăci pozitive, iar cel negativ la blocul plăcilor negative.
Curentul de încărcare 13 este direcționat în interiorul electrolitului de la plăcile pozitive la cel negativ. Prin urmare, ionii negativi ai reziduului acid sunt adecvați pentru plăcile pozitive. și ioni negativi - ioni de hidrogen pozitivi 2H +.
Reacțiile chimice la o încărcătură pot fi reprezentate prin următoarea ecuație: P1eb4 + PbSiO4 + 2H2O Pb (02 + 4 2H2 804.
În timpul încărcării sulfat de plumb este transformata in RB04 R02 dioxid de plumb pe plăcile pozitive și plumb spongioase Pb la plăcile negative. Concomitent, este creșterea cantității de acid sulfuric în soluție, ceea ce crește densitatea electrolitului, atâta timp cât întregul sulfat de plumb nu este convertit în compuși activi care au fost în bateria înainte de descărcare. Prin urmare, densitatea electrolitului la sfârșitul densității electrolitului este la începutul descărcării de gestiune. În cazul bateriilor staționare, densitatea electrolitului la sfârșitul încărcării atinge 1,2-1,21 g / cm3; y acumulatoare ABN densitate tip electrolit atinge 1,18-1,2 g / cm3 și vara 1,3-1,32 g / cm3, în timpul iernii. După recuperarea masei active pe plăcile de curentul de încărcare al electrolitului se descompune apa în hidrogen și oxigen, care sunt amestecate pentru a forma un amestec exploziv,
numit un gaz zgomotos. Descompunerea apei prin curent electric este detectată prin alocarea intensivă a bulelor de oxigen și oxigen pe suprafața electrolitului ("fierbere").
Articole similare
-
Înlocuirea electroliților în bateria mașinii - ghid video pas cu pas
-
Înlocuirea electrolitului în baterie ca înlocuitor, cât trebuie să fie turnat
Trimiteți-le prietenilor: