Gazul în care arde fierul
În cazul în care aerul nu conținea azot, ci a constat în întregime din oxigen, viața organismelor s-ar dezvolta, desigur, adaptându-se la respirația oxigenului pur.
Ar fi periculos o astfel de compoziție a atmosferei: inflamabilitatea majorității obiectelor din jurul nostru.
Groaznic și acum se declanșează în sate și orașe, cu preponderență clădiri din lemn, dar de multe ori mai mult ar fi un risc în cazul în care aerul nu a fost implicat în 4/5 din azotul nu intretine arderea. Apoi ar arde nu numai cărbune și lemn, ci și cele mai multe metale. S-au ars cu ușurință nu numai cabane de lemn și case, ci și poduri de fier și șine, precum și nave gigantice ale mării.
Pentru a arăta exemple de inflamabilitate în substanțe de oxigen pur care nu ard sau ard doar în aer, vom obține puțin din acest gaz.
Fig. 24. Tăierea metalului cu autogen
Oxigenul este de asemenea obținut altfel. Astfel, oxidul de bariu [16], atunci când este încălzit, atașează oxigenul în sine, transformându-se în peroxid de bariu, iar acesta din urmă, cu o incandescență mai puternică, o eliberează din nou. În ultimii ani, oxigenul din aer este produs în mod similar, dar în loc de oxid de bariu, se folosește o altă substanță care este mai complexă în compoziție.
În manualele de chimie, se indică de obicei că oxigenul este produs prin descompunerea oxidului mercur sau a unui amestec de sare alcalină clorat (bertolet) și peroxid de mangan (pyrolusit). Prima metodă este potrivită pentru obținerea unor cantități foarte mici de gaz, a doua nu este sigură și ambele necesită o încălzire puternică.
Cel mai bine este să ilustrăm pericolul de sare de bertonturi, acest medicament nevinovat pentru gargară [17]. o astfel de imagine:
„Cazul de alocare a cea mai mare cantitate de oxigen, care este cunoscut doar pentru noi, a avut loc 12 mai 1899 la o uzină chimică din Saint-Gelense, deoarece sarea cloratului este accidental prea cald. Aproximativ 150 de tone de sare fierte, ambalate în butoaie, sunt în stoc de așteptare trimiterea. cumva scânteie din butoi, care este rulat în camera unde sarea cristalizată, a lovit cadrul de lemn al rezervorului de cristalizare. arborele este impregnat de sare cloratul, era foarte capabil de aprindere. Și dei și gol, am izbucnit un incendiu teribil care a crescut în sus, și câteva minute mai târziu a fost cuprins de acoperiș flăcări clădirii A fost o scenă teribilă :. o strălucire incredibilă strălucitoare rând pe rând de butoaie bine stivuite de sare de clorat, a provocat o eliberare masivă de gaz cu oxigen pur, care este consumată în toate direcțiile. toate structurile din lemn imersată astfel atmosfera de oxigen pur, arzând cu o mare forță, astfel încât întreaga clădire în curând incandescente, arzând cu o strălucire, ca în cuptorul de topire. În cele din urmă, când oxigenul nu mai putea să iasă din butoaiele, sarea a explodat.
Și ce explozie. Două lovitură uriașă, urmat rapid unul după altul, și a spus orașul despre dezastrul a lovit, și nori de fum negru a crescut în forma unei coloane gigant indică locul exploziei. Întreaga fabrică a fost spulberată. Clădirile și depozitele erau la același nivel cu solul. Macaralele mobile mari au ars ca și meciurile. Partea superioară a gașcănei vecine [18] a fost ruptă în bucăți și aproximativ 1/4 milioane de metri cubi. picioarele de gaz flaming au crescut în aer. Flying și arderea tăciunele răspândi focul, care a fost un spectacol remarcabil al unui pilon imens de flăcări, cu un vuiet teribil, ridicându-se la 500-600 de picioare în înălțime. Lovitura era atât de teribilă încât pământul ezita, ca într-un cutremur. Casele au fost demolate ca un vânt; de-a lungul milelor, toată paharul era spulberat de un val de aer gigantic, în timp ce întregul oraș era în panică. Pasagerii trenului care tocmai a tras în gară, au fost supuse unor încercări teribile că, deși stația era departe de locul exploziei, mașini returnate pe teren, și toate ferestrele au fost sparte ca și cum cineva în mod deliberat și imediat.
Probabil aproximativ un milion și jumătate de milion de metri cubi. picioarele de oxigen gaz în acest mod imediat turnat în aer. Această catastrofă a fost o simplă repetiție, numai în proporții enorme, una dintre aventurile care au loc cu cineva care începe să studieze chimia în practică, tocmai în prepararea oxigenului prin încălzirea sarei bertolet "[19].
Nu este mai bine să obțineți oxigenul într-un alt mod, mai sigur? Da!
Și vă sfătuiesc să o obțineți cu acțiunea de potasiu de mangan-acid pe peroxid de hidrogen.
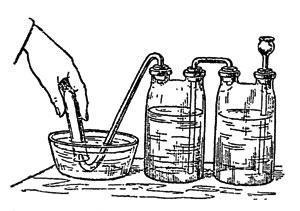
Fig. 25. Extracția oxigenului
Ambele pot fi ușor obținute la orice farmacie. Soluție puternică de peroxid de hidrogen se toarnă într-un balon cu o pâlnie sau un balon vsypte două gâturi la același hidrogen-mangan de potasiu și se colectează oxigenul degajat în butelii sau sticle umplute cu apă și răsturnată deschidere descendentă în baie pneumatică (Figura 25.), - scurt, așa deoarece hidrogenul a fost colectat. Numai prin eliminarea din baie umplută cu gaz, loc deschiderea lor în sus, care acoperă o placă de sticlă mată, deoarece oxigenul este puțin mai greu decât aerul.
Fier de călcat
Înfășurați un fir de fier subțire asezat în jurul creionului, puneți o bucată de plută la capăt, luminați-l pe cel din urmă și coborâți firul într-un vas cu oxigen. Puteți introduce direct capătul liber al firului într-un dop moale și îl închideți cu o sticlă de gaz. În partea de jos a sticlei este necesar să lăsați puțină apă, adică să colectați oxigenul degajat în el, nu să-l înlocuiți din vas cu toată apa. În acest caz, scara (produsele de combustie cu fier), care rezultă din arderea fierului, se răcește în apă sau altfel se poate sparge fundul sticlei (Figura 26).
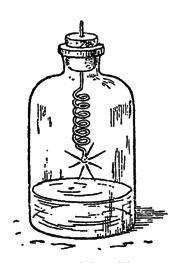
Fig. 26. Arderea fierului în oxigen
Colectați oxigenul într-o sticlă de sticlă verde închis și luminați o panglică de magneziu (printr-un pahar alb, lumina va fi atât de strălucitoare încât poate deteriora ochii).
Se toarnă într-un vas de apă, se agită bine cu pulberea de oxid de magneziu care rezultă și după un timp încearcă, după cum spun chimistii, reacția lichidului. În ciuda solubilității nesemnificative a oxidului de magneziu în apă (cu formarea unui hidrat de oxid), reacția va fi ușor alcalină. Hârtia turnantă se va transforma într-o culoare albăstrui. Acest lucru arată cât de lent sensibil la acizi și alcali, deoarece o parte din greutate de oxid de magneziu se dizolvă în numai 55.000 de părți de apă.
Greșeala lui Jules Verne
Romanul lui Jules Verne „Insula misterioasă“ are următoarele linii: .. „Apoi, minereu și cărbune au fost plasate în straturi alternante - un strat de minereu stratului de cărbune, etc. Acum, după ce cărbunele este aprins iar grămada va forța burdufului de aer în acesta în urma proceselor chimice să apară: aer sub influența abundente arderea cărbunelui de alimentare cu oxigen, este transformat în bioxid de carbon sub formă de acid carbonic, care acționează asupra minereului de oxid de fier, este nevoie de ea particula de oxigen și, astfel, o distinge de fier pur.“.
De data aceasta Jules-Verne a fost greșit!
Bioxidul de carbon, mai corect - anhidrida de carbon - combinația finală dintre carbon și oxigen. Nu poate lua oxigen din oxidul de fier. De fapt, combustia incompletă a carbonului formează monoxid de carbon, care ia oxigen din minereu, transformându-se în anhidrida carbonică.
Fierul eliberat nu este pur, conține un amestec de carbon.
Vieți mort
Este mult mai ușor să colorezi hârtia cu albastru, dacă repeți ultimul experiment, înlocuind magneziul cu potasiu sau sodiu. Este foarte ușoară (mai ușoară decât apa) alb argintiu într-o tăiere proaspătă, moale ca ceară metale, care, ca și calciu, trebuie să fie depozitate în kerosen. De asemenea, produc hidrogen din apă, dar această reacție merge mai energic, însoțită de o astfel de încălzire, încât gazul în evoluție se aprinde, iar metalele încep să ardă împreună cu el. Nu vom face acest experiment și nu îl veți recomanda - este adesea însoțit de o mică explozie, periculoasă deoarece lichidul caustic poate să vă stropi în ochi și să provoace nenorocire iremediabilă. Acum vreau să arăt o altă experiență.
Cu atenție, fără a atinge mâinile de sodiu, scoate din forcepsului borcan de separare cuțit magnitudine bucată în mazăre mici sau șterge hârtie capacitate kerosenul, pus într-un metal lingură de fier prin încălzire în flacăra unei lămpi de alcool.
Articole similare
Trimiteți-le prietenilor: