Există multe definiții ale termenului "apoptoză":
- Fenomenul de moarte celulară programată, însoțită de un set de caracteristici citologice caracteristice (markeri ai apoptozei) și a proceselor moleculare diferențe între organisme unicelulare și pluricelulare (adică, schimbări în structura și funcționarea celulelor caracteristice apoptozei) aferente.
- forma de moarte celulară, manifestată printr-o scădere a mărimii, condensarea (condensarea) și fragmentarea cromatinei, densificarea membranelor exterioare și citoplasmice fără eliberarea conținutului de celule în mediu.
Esența apoptozei constă în faptul că aceasta este o moarte celulară programabilă, adică există anumite mecanisme, ca urmare a faptului că celula însăși își sfârșește existența.
In apoptoza organism pluricelular ohm celulelor moarte în timpul embriogenezei, celulele T în timpul diferențierii în timus, celulele infectate cu viruși, celule anormale (atunci când există procese apoptotice de intensitate insuficientă a dezvolta cancer) si multe altele. dr.Osnovnoe apoptoza scop biologic și este în proces de a crea organe morfonegeza embrionare și țesuturi la configurațiile evoluționar fixe și dimensiunile și apoi să mențină acești parametri, cu toleranțele acceptabile pentru viață.
Cea mai importantă manifestare a acestei apoptoze după terminarea dezvoltării oamenilor și a altor mamifere este participarea sa la procesul de regenerare fiziologică (reînnoire) a celulelor țesuturilor și organelor diferite și menținerea homeostaziei celulare. Regenerarea în diferite grade de severitate de-a lungul vieții lor expuse la aproape toate celulele corpului nostru. Deosebit de reînnoire celulară intensă are loc în celulele epiteliale în contact cu mediul extern, pielea, gastro-intestinale, genito-urinar și sistemele pulmonare, precum si in celulele sanguine ale sistemului imunitar.
Rolul important în procesele de respingere a organelor și țesuturilor străine în timpul transplantului.
O altă funcție importantă a apoptozei este controlul asupra mediului intern al celulei, inclusiv a nucleului celular cu conținutul său. Adevărat, sa demonstrat acum că apoptoza poate apărea, de asemenea, în celulele care nu au nuclee. Dacă există încălcări în celulă care depășesc limitele admise, celula suferă o autodistrugere. Apoptoza apare prin acțiunea a diverși factori dăunători care pot provoca necroza, dar pot acționa în doze mici, de exemplu, cu acțiunea temperaturii înalte, a radiației ionizante, a medicamentelor antitumorale.
Apoptoza a fost implicat activ într-o serie de procese fiziologice și patologice. De exemplu, atunci când un dependent hormonal involuție organe la adulți, în special, respingerea endometrului în timpul ciclului menstrual, atrezia foliculilor (imperforat) in ovare la menopauză, și regresie (dezvoltare inversa) cancer de sân după încetarea lactației.
Rolul apoptozei a și atrofia patologică a organelor dependente de hormoni, de exemplu, atrofia prostatei după castrare și epuizarea limfocitelor în timus în timpul terapiei cu glucocorticoizi, este mare. Sau atrofie patologică a organelor parenchimatoase după obturatie (ocluzie) a canalelor excretoare care apare in pancreas si glandele salivare, rinichi. Moartea celulelor în procesul de atrofie observate în cortexul adrenal sub actiunea glucocorticoizi sau atrofia țesuturilor dependente de endocrine.
În multe cazuri de efecte ischemice sau toxice acute sau cronice, moartea celulară survine prin apoptoză. Acest tipar se observă în accident vascular cerebral, infarct miocardic, dar și în rinichi, cu diabet, forme individuale de nefrită, boli neurodegenerative, cum ar fi Alzheimer și Parkinsons. În patogeneza afectării toxice a ficatului, a pancreasului și a rinichilor, activarea apoptozei este, de asemenea, importantă.
Forme de moarte celulară, diferențele lor
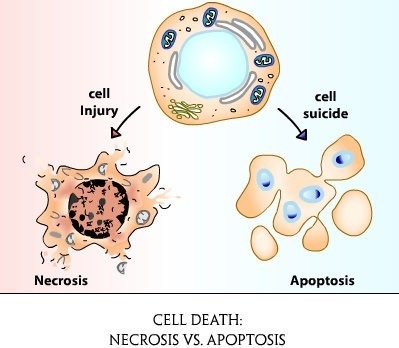
Există două forme de moarte celulară - necroză și apoptoză.
Necroza este un proces patologic care se manifestă în moartea țesutului local într-un organism viu ca rezultat al unei pagube exo (exterioare) sau endogene (interne) a acestuia. Necroza se manifestă prin umflarea, denaturarea și coagularea proteinelor citoplasmatice, distrugerea organelurilor celulare și, în final, a întregii celule.
Diferența principală dintre necroza si apoptoza si este apoptoza - o moarte celulara programata si necroza - un proces patologic este inițiat ca răspuns la orice efecte daunatoare (infectie, expunerea chimice, expunerea, alimentarea cu sange insuficient, etc.) .
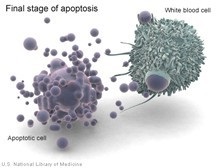
În procesul de apoptoză și celule implicate cascade moleculare complexe, ca rezultat al căreia există o contracție a membranei citoplasmatice, reducând discontinuitățile volumul celulei filamentele de condensare nucleară ADN cromatinei la periferie nucleară, dezintegrarea ulterioară a nucleului în părți, celule fragmentare vezicule (vezicule) cu intracelular conținuturi - corpi apoptotici, care sunt captate de către celulele vecine și fagocitelor pot, la fel ca în cazul necrozei. celulare descărcarea conținutului nu se produce, nu există nici o inflamație.
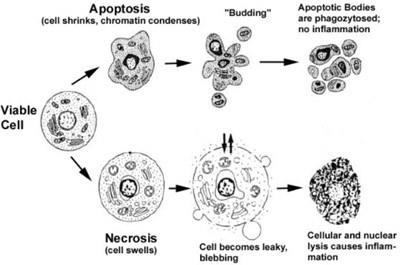
Cu necroza, dimpotrivă, există eliberarea de enzime lizozomale din lizozomi, care digeră atât conținutul celulei, cât și celulele se umflă și explodează. Conținutul de celule este aruncat în mediul extracelular, unde este absorbit de fagocite, se dezvoltă inflamații.
Apoptoza este un proces fiziologic, necroza-patologică.
Există și alte forme de moarte programabilă, de exemplu autofagia. Procesul autofagiei este că organele se leagă de lizozomi, unde sunt digerați de enzime lizozomale. Apoi, resturile celulei absorb macrofagele.
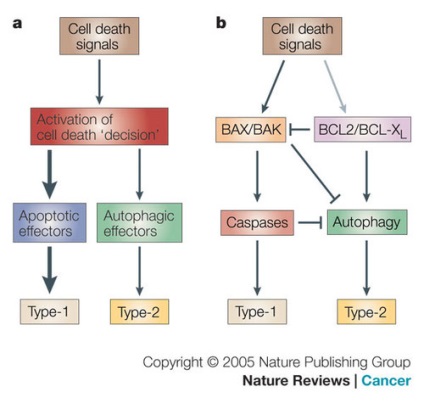
a) - Modelul cinetic al echilibrului apoptozei a și autofagiei. Unul dintre efectele letale activează programul în celulă, iar celula "decide să moară". Dacă sunt suficientă efectoare apoptotice (molecule implicate în apoptoza a), atunci apoptoza este singurul răspuns al majorității celulelor la efectele letale. Supresia efectoarelor apoptotice declanșează o cale alternativă-autofagie.
b) - Model inhibitor. Când efectele letale activa BAX / BAK- dependentă cale mitocondriale vnemembranny (BAX / BAK-dependent mitocondriale membrană exterioară cale permeabilizare) declanseaza apoptoza. BAX / BAK, precum și caspaza, este un inhibitor activ al BCL2 / BCL-XL, facilitând autophagy. Apoptoza activă suprimă autofagia.
Modelul 3D al apoptozei
Mecanisme de apoptoză
Mecanismele de apoptoză sunt complexe și diverse, reprezintă o cascadă moleculară complexă, pe care multe și multe laboratoare din întreaga lume sunt implicate în studiu. Importanța incontestabilă a acestor studii în aspectul oncologiei și gerontologiei este dovedită de succesul terapiei bolilor oncologice cu inductorii apoptozei în celulele canceroase. Deci, care sunt mecanismele. Să vorbim despre asta în detaliu.
Prima etapă este o ordine de deces
Unde începe acest proces complex? Deoarece celula primește o "ordine de moarte", moartea ei este necesară pentru viața viitoare a organismului. Acest lucru se întâmplă cu ajutorul semnalelor din mediul extracelular, pe care celulă le percepe cu ajutorul aparatului receptor. Uneori semnalul pentru debutul apoptozei poate fi și absența unui semnal necesar.
Ca rezultat al contactului moleculelor de semnal cu partea exterioară a proteinei receptorului, acest receptor suferă modificări structurale. Rearanjarea structurală captează, de asemenea, porțiunea intracelulară a moleculei receptorului. Poate fie să posede o activitate enzimatică în sine, fie să fie strâns legată de anumite enzime celulare. Schimbarea activității moleculei receptorului duce la activarea enzimei.
Adesea, este vorba de schimbarea concentrației de ioni de calciu. și, de asemenea, niște compuși organici cu conținut de fosfor relativ mici, care aparțin clasei de nucleotide.
Compușii activi apar, de asemenea, ca rezultat al hidrolizei anumitor lipide ale membranei celulare. La rândul său, toate acestea conduc la atașarea sau detașarea reziduurilor de fosfat din moleculele regulatoarelor de proteine (fosforilare), capabile să influențeze aparatul genetic al celulei.
Fosforilarea și defosforilarea (scindarea reziduului de acid fosforic), precum și alte modificări biochimice modifică activitatea acestor regulatori.
Receptorii percepând un "semnal letal"
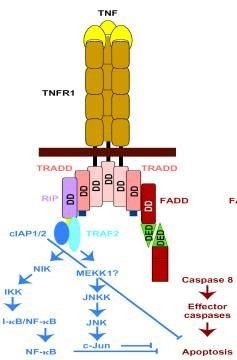
Sunt cunoscuți doi receptori omologi structurali ai TNF. p55 și p75 (TNF-RI și, respectiv, TNF-RII) legate de proteinele de tip I transmembranare. În plus, sunt implicați "receptorii morții" CD95. Receptorii CD95 și receptorii TNF aparțin unei superfamilii în creștere a receptorilor care au omologie în domenii extracelulare. Familia include, de asemenea, receptorul factorului de creștere a nervilor. Antigenul CD40 al celulelor B. un marker de activare a limfocitelor T CD27 și a unor proteine omoloage de mamifere și viruși.
CD95 și TNF-R1 au o secvență omologă suplimentară în partea intracelulară a moleculelor. Această transducție este un semnal citotoxic (celulă-dăunătoare). C-terminalul citoplasmatic al CD95 conține, de asemenea, "domeniul de salvare". a căror îndepărtare amplifică activitatea citotoxică a receptorului.
ligand TNF și CD95 (CD95-L) sunt proteine transmembranare cu un al doilea tip de extracelular C-terminal, N-terminal intracelular și elemente unice transmembranare, dar ele pot funcționa într-un solubil, „exfoliate“ de forma membranei. Și CD95-L, TNF și se leagă la receptorul corespunzător ca trimer, molecula receptor 3 „reticulat“, care activează pentru transmiterea semnalului pro-apoptotice.
Mecanisme intensive de semnalizare cercetare și apoptoza indusă de anti-CD95 / CD95-L și TNF, au condus la progrese semnificative în două direcții - identificarea proteinelor care interacționează cu CD95 și TNF-R1 și elucidare a participării la procesul de al doilea ceramide mesager.
"Domeniul morții" al TNF-R1 interacționează de asemenea cu proteina kinază serină / treonină și este fosforilat de această enzimă. Cele 30 de resturi de aminoacizi C-terminale inhibă legarea receptorului de proteina kinază. Rolul acestor evenimente în transmiterea unui semnal citotoxic este neclar. Tirozină fosfataza a fost descrisă recent. FAP-1. interacționând cu cei 15 aminoacizi C-terminali ai CD95, "domeniul de salvare". Hyperexpresia FAP-1 suprimă apoptoza. mediată de CD95.
Proteinele descrise sunt implicate, aparent, în stadiile inițiale ale transmiterii semnalului. Un alt grup de date indică faptul că CD95-L sau un anticorp la CD95 și TNF activează calea de transmisie sfingomielina.
Etapele ulterioare ale morții celulare induse de CD95 și TNF-R1, sunt aceleași ca și în apoptoza e. Moartea celulară clasice pot fi prevenite prin crmA. care indică participarea proteazelor asemănătoare ICE. Bcl-2 suprimă apoptoza. indusă prin CD95 și TNF-R1, cel puțin pe unele linii celulare.
Participarea FAS (CD95)
Aceasta cale letală de semnalizare poate fi reprezentată schematic după cum urmează: Bobinele - receptor - adaptoare -kaspazy primul -regulators nivel -kaspazy doilea nivel. Astfel, un receptor, desemnat Fas, care interacționează cu un ligand adecvat (FasL), o proteină transmembranară a unui T-killer este activată și începe moartea celulelor de program infectat cu virus. În același mod, prin reacția cu FasL ligand pe suprafața limfocitelor Th1 sau anticorp la corpul matriței Fas-receptor devin limfocitele B recuperate inutile, producătorii de anticorpi care transportă Fas-receptor. FasL este un ligand aparținând unei familii mari de factor de necroză tumorală a TNF. Această familie de liganzi homotrimerică (adică substanțe biologic active (proteine) care constau din trei domenii identice (părți) cu excepția FasL și TNFa. Include TNFb (limfotoxină).
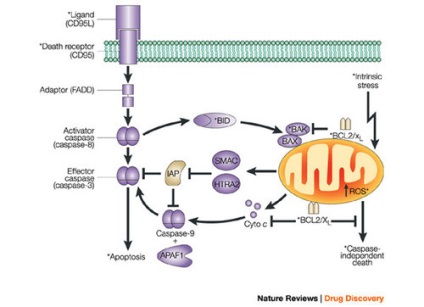
Fas este un membru al familiei de receptori TNF. După cum sa menționat mai sus, toate acestea sunt reprezentate de proteine transmembranare care interacționează cu porțiunile extracelulare trimeri inductori liganzi. Receptor și interacțiunea ligand conduce la formarea de clustere de molecule de legare a receptorului și porțiunile lor intracelulare de adaptoare. Adaptor contactarea receptorului interacționează cu efectorii încă precursori inactivi din familia proteazelor caspazei primul nivel (caspazelor de inițiere).
adaptor de interacțiune cu receptorii și efectorii prin interacțiune proteină-proteină homofilă domenii mici: DD (domeniul morții - domeniul morții), DED (domeniul morții-efector - domeniu efector al morții), CARD (- domeniu de activare si recrutare caspase). Toți au o structură similară, care conține șase secțiuni a-elicoidale. Domeniile DD (domeniu deces) implicate în Fas adaptor interacțiune receptor c (DD-proteina Fas-asociate) FADD. Domeniile DED participă la interacțiunea adaptorului FADD cu procaspasele 8 și 10.
Cea mai detaliată este caracterizată prin procaspase-8, recrutată de receptorul Fas prin adaptorul FADD. Agregate formate FasL - Fas - FADD - procaspase-8. Agregatele similare în care sunt activate caspazele se numesc apoptoze. saperonii apoptotici. sau complexe de semnalizare care induc moartea.
Procaspase prezintă o activitate proteolitică neglijabilă este de 1-2% din activitatea caspazelor mature. Ca și în formă monomerică, procaspase a cărui concentrație este neglijabilă într-o celulă, ele sunt în stare latentă. Se presupune că spațiale moleculele de aproximare prokaspaz în timpul agregării lor conduce la formarea caspazelor active, prin intermediul mecanismului proteolitică a auto- și încrucișate clivaj (procesare trans auto- sau)]. Ca urmare a procaspase (greutate moleculară de 30-50 kDa) este separat domeniu de reglare N-terminal (prodomeniul), iar restul moleculei este împărțită într-o mare (
10 kDa) din subunitate (Figura 3). Apoi apare asocierea subunităților mari și mici. Două heterodimeri formează un tetramer cu două regiuni catalitice care acționează independent unul de celălalt. Astfel, procaspaza-8 este activată și eliberată în citoplasmă sub formă de caspază-8. Există și alte modalități de activare a caspazei-8 - care implică receptorii TNFR1 și DR3.
În stadiul activării caspazei primului eșalon, viața celulei poate fi în continuare menținută. Există controale care blochează sau, dimpotrivă, crește acțiunea distructivă a caspazelor primul eșalon. Acestea includ Bcl-2 proteine (inhibitori ai apoptozei ca: A1, Bcl-2, Bcl-W, Bcl-XL, Brag-1, Mcl-1 și NR13) și Bax (promotori de apoptoză: Bad, Bak, Bax, Bcl -XS, Bid, Bik, Bim, Hrk, Mtd). Aceste proteine sunt conservate evolutionarily: homolog de Bcl-2 detectat chiar și bureți în care este necesară pentru apoptoza morfogenezei.
Caspaza-8 activează caspaza celui de-al doilea eșalon (caspază efectoare): prin proteoliza din procaspaza-3 se formează caspaza-3, după care procesul lansat de programul de deces este ireversibil.
Caspaza-3 este capabil de auto-activare suplimentară (sau avtoprotsessingu autocataliză) activează un număr de alte proteaze ai familiei caspazelor activează factorul fragmentarea ADN-ului conduce la o degradare ireversibilă în nukleosomalnye fragmente de ADN. Astfel, este lansată o cascadă de enzime proteolitice, care efectuează apoptoză.
Trimiteți-le prietenilor: