Nikolay Nikolaevich Beketov (1827-1911)
1. Cu cât potențialul electrodului este mai mic al unui metal, cu atât este mai activ chimic, este mai ușor de oxidat și este mai greu de recuperat din ionii săi. Metalele active există în natură numai sub formă de Na, K. Compușii se găsesc în natură atât sub formă de compuși, cât și în stare liberă de Cu, Ag, Hg; Au, Pt - numai în stare liberă;
2. metale care au un potențial de electrod mai negativ decât magneziu, înlocuind hidrogenul din apă;
3. metalele care stau într-o serie de solicitări la hidrogen, înlocuind hidrogenul din soluțiile de acizi diluați (ale căror anioni nu prezintă proprietăți oxidante);
4. Fiecare metal din rând, care nu descompune apa, îndepărtează metalele care au mai multe valori pozitive ale potențialului electrodului din soluțiile sărurilor lor;
5. Cu cât mai multe metale diferă în valorile potențialelor electrodului, cu atât este mai mare valoarea emf. va avea o celula galvanica construita din ele.
Dependența potențialului electrodului (E) de natura metalului, activitatea ionilor săi în soluție și temperatura este exprimată prin ecuația Nernst
unde E o Me este potențialul electrodului standard al metalului și Me n + este activitatea ionilor metalici din soluție. La o temperatură standard de 25 ° C, pentru soluțiile diluate, înlocuind activitatea (a) cu concentrația (c), logaritmul natural este zecimal și înlocuind valorile lui R. T și F, obținem
De exemplu, pentru un electrod de zinc plasat într-o soluție de sare a acestuia, concentrația de ioni de hidratat Zn2 × mH2O va fi abreviată ca Zn2 +. atunci
Dacă [Zn 2+] = 1 mol / dm 3. atunci EZn = E o Zn.
Elemente galvanice, forța lor electromotoare
Două metale scufundate în soluțiile sărurilor lor, conectate printr-un conductor, formează o celulă galvanică. Prima celulă galvanică a fost inventată de Alexander Volt în 1800. Elementul a constat din plăci de cupru și zinc separate de pânză umezită cu o soluție de acid sulfuric. Odată cu îmbinarea succesivă a unui număr mare de plăci, elementul Volta are o forță electromotoare considerabilă (emf).
Apariție curentului electric în celulă datorită diferenței de potențial de electrod de metale prelevate și este însoțită de schimbări chimice ce au loc pe electrozi. Să luăm în considerare funcționarea unei celule galvanice pe baza unui element cupru-zinc (J. Daniel - BS Jacobi).
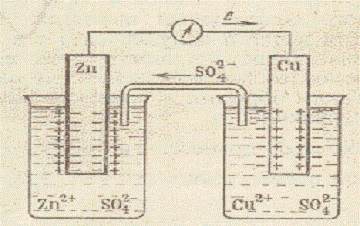
Schema celulei galvanice cupru-zinc a lui Daniel-Jacobi
Boris Semenovici Jacobi (Moritz Herman) (1801-1874)
Oxidarea zincului (dizolvarea zincului) Zn o-2e = Zn 2+ are loc pe electrodul de zinc, imersat într-o soluție de sulfat de zinc (c = 1 mol / dm 3). Electronii intră în circuitul extern. Zn este sursa de electroni. Sursa de electroni este considerată a fi un anod electrod negativ. Pe electrodul cuprului, imersat într-o soluție de sulfat de cupru (c = 1 mol / dm 3), ionii metalici sunt reduse. Atomii de cupru sunt depozitați pe electrodul Cu 2+ + 2e = Cuo. Electrodul de cupru este pozitiv. El este catodul. În același timp, o parte din ionii de SO4-2 trece prin puntea de sare într-un vas cu o soluție de ZnS04. Adăugând ecuațiile proceselor care au loc la anod și catod, obținem ecuația totală
sau sub formă moleculară
Aceasta este reacția obișnuită de reducere a oxidării care se desfășoară la interfața cu soluția metalică. Energia electrică a unei celule galvanice este obținută printr-o reacție chimică. Celula galvanică luată în considerare poate fi scrisă sub forma unei scheme electrochimice scurte
O condiție necesară pentru funcționarea unei celule este diferența de potențial, se numește forța electromotoare a unei celule galvanice (emf). emf Orice celulă galvanică de lucru este pozitivă. Pentru a calcula valoarea emf. celula galvanică trebuie luată din valoarea unui potențial mai pozitiv pentru a lua o valoare mai mică decât potențialul pozitiv. Deci emf. (t = 25 ° C, c = 1 mol / dm 3. P = 1 atm) este egal cu diferența dintre potențialul electrodului standard de cupru (catod) și zinc (anod)
Cuplat cu zinc, ionul de Cu2 + este redus.
Potențialele de diferență de electrod necesare pot fi create folosind aceeași soluție de concentrații diferite și electrozi identici. O astfel de celulă galvanică se numește o celulă de concentrare. și funcționează prin egalizarea concentrației soluției. Un exemplu este un element compus din doi electrozi de hidrogen
Dacă p = 101 kPa, s <с``, то его э.д.с. при 25 о С определяется уравнением
Pentru c '= 1 mol-ion / dm 3 emf elementul este determinat de concentrația de ioni de hidrogen în cea de-a doua soluție, adică E = 0,059lgc `` = -0,059 pH.
Determinarea concentrației ionilor de hidrogen și, în consecință, a pH-ului mediului prin măsurarea emf. Celula galvanică corespunzătoare se numește potențiometrie.
Trimiteți-le prietenilor: