LECȚIA 10 Clasa a Xa (primul an de studiu)
Plan de reacții de reducere a oxidării
1. Reacții de reducere a oxidării (OVR), starea de oxidare.
2. Procesul de oxidare, cei mai importanți reductori.
3. Procesul de recuperare, cei mai importanți oxidanți.
4. Dualitatea de reducere a oxidării.
5. Principalele tipuri de OVR (intermoleculare, intramoleculare, disproporție).
7. Metode de compilare a ecuațiilor EIA (echilibru electron și electron-ion).
Toate reacțiile chimice pe baza schimbărilor în stări de oxidare ale atomilor implicați în acestea pot fi împărțite în două tipuri: IAD (care apar cu o schimbare în stări de oxidare) și IAD.
Gradul de oxidare este o sarcină condiționată a unui atom dintr-o moleculă, calculată pe presupunerea că în moleculă există numai legături ionice.
P rivilaa l d e d e d e l d e n d e n d e d e d e s
Gradul de oxidare a atomilor de substanțe simple este zero.
Suma gradelor de oxidare a atomilor într-o substanță complexă (într-o moleculă) este zero.
Gradul de oxidare a atomilor de metal alcalin +1.
Gradul de oxidare a metalelor alcalino-pământoase +2.
Gradul de oxidare a atomilor de bor și aluminiu este +3.
Gradul de oxidare a atomilor de hidrogen +1 (în hidruri de metale alcaline și alcalino-pământoase -1).
Gradul de oxidare a atomilor de oxigen -2 (în peroxizi -1).
Orice OBR este un set de procese de recul și atașarea electronilor.
Procesul de recul a electronilor se numește oxidare. Particulele (atomi, molecule sau ioni) care dau electroni se numesc agenți reducători. Ca rezultat al oxidării, starea de oxidare a agentului reducător crește. Agenții reducători pot fi particule într-o stare de oxidare inferioară sau intermediară. Cei mai importanți agenți reducători sunt: toate metalele sub formă de substanțe simple, în special cele active; C, CO, NH3. PH3. CH4. SiH4. H2S și sulfuri, halogenuri de hidrogen și halogenuri ale metalelor, hidruri metalice, nitruri metalice și fosfizi.
Procesul de aderare a electronilor se numește recuperare. Particulele care primesc electroni se numesc oxidanți. Ca urmare a reducerii, starea de oxidare a oxidantului scade. Oxidanții pot fi particule în starea de oxidare superioară sau intermediară. oxidanti majore nemetale substanță simplă având o electronegativitate ridicată (F2 Cl2 O2 ..), permanganatul de potasiu, cromați și bicromați, nitrați și acid azotic, acid sulfuric, acid percloric și perclorat concentrat.
Substanțele care conțin particule într-o stare de oxidare intermediară pot acționa atât ca oxidanți, cât și ca agenți reducători, i. E. prezintă dualitate de reducere a oxidării. Acestea sunt acid sulfuric și sulfuri, acid hipocloros și hipoclorit, peroxizi etc.
Există trei tipuri de reacții de reducere a oxidării.
Oxidatorul OVR intermolecular și un agent reducător sunt incluse în diferite substanțe, de exemplu:
OVR intramoleculară - un oxidant și un agent reducător sunt incluse într-o singură substanță. Pot fi diferite elemente, de exemplu:
sau un element chimic în diferite grade de oxidare, de exemplu:
Disproporționare (vindecare autooxidare auto) - oxidant și agentul reducător este unul și același element situat într-o stare de oxidare intermediar, de exemplu:
OVR are o importanță deosebită, deoarece majoritatea reacțiilor apărute în natură sunt de acest tip (procesul de fotosinteză, ardere). În plus, OVR este folosit în mod activ de om în activitățile sale practice (recuperarea metalelor, sinteza amoniacului):
Pentru a compune ecuațiile EIA, se poate utiliza metoda echilibrului electronic (circuite electronice) sau metoda echilibrului ion-ion.
Metoda echilibrului electronic:
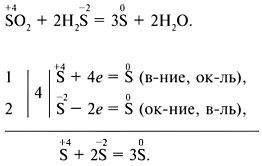
Metoda echilibrului ion-ionic:
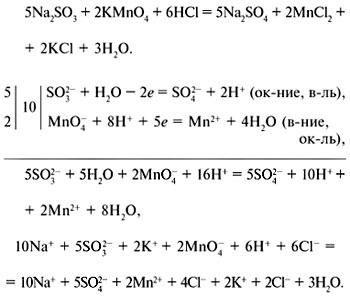
Articole similare
Trimiteți-le prietenilor: