Inițiatorul polimerizării cationice este o sursă de particule încărcate pozitiv, care apar fie spontan, fie prin reacție cu un monomer sau un compus administrat în mod specific. În mod tipic, inițiatorii sunt substanțe acide: protoni și acizi aprotici, complecși ai acidului Lewis cu compuși donor de electroni, carbonați de tipul Ph3C + · SbCl6. Sărurile de oxoniu de tip Et3O + · SbCl6
Lewis acizii sunt AICI3. BF3. SnCI4. ZnCI2. TiCl4, etc. - sunt utilizate pentru polimerizarea cationică la temperaturi scăzute a alchenelor, conducând la formarea de polimeri cu înaltă moleculare. Acești acizi sunt utilizați în mod obișnuit în combinație cu donatori de protoni sau alți aditivi.
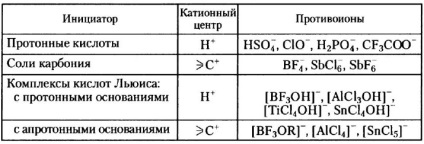
Tabelul 1. Unii inițiatori cationici ai polimerizării alchenelor
Acizii protic pentru inițierea polimerizării cationice sunt utilizați numai dacă anionul format de ei nu se distinge prin nucleofilicitate puternică; în caz contrar formează o legătură covalentă cu monomerul protonat:
Datorită nucleofilității ridicate a halogenurilor, acizii halogenați nu sunt utilizați ca inițiatori de polimerizare cationici. Pentru polimerizarea unor monomeri (de exemplu, hidrocarburi nesaturate superioare, cumaron, inden), acizi fosforici, sulfurici și clorici se utilizează, deși oligomerii sunt de regulă obținuți ca regulă.
Astfel, izobutilenul nu este sensibil la BF3 uscat. dar polimerizează instantaneu atunci când se adaugă urme de apă; activatorul (apa) reacționează cu inițiatorul pentru a forma un complex care protonizează monomerul și formează particule cationice care inițiază o creștere suplimentară a lanțului:
La etapa de inițiere, protonul este atașat la molecula de monomer și la o pereche de ioni
Această pereche de ioni reacționează apoi cu următoarea moleculă de monomer:
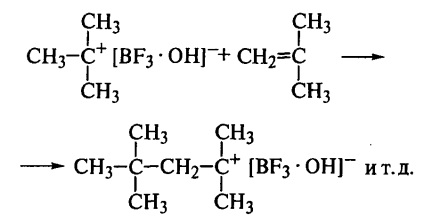
Astfel, la sfârșitul lanțului de creștere, există întotdeauna o carbocație cu un anion anionic. Datorită polarizării moleculei de monomeri, este asigurată atașarea regulată a legăturilor "cap-la-coadă", deoarece un alt tip de atașament nu este pur și simplu posibil aici. Prin urmare, lanțul de polimeri are o structură chimică regulată. Permitivitatea dielectrică scăzută a mediului (hidrocarburi clorurate) contribuie la conservarea perechii de ioni în timpul creșterii lanțului.
În general, procedeul de inițiere a polimerizării cationice în prezența acizilor Lewis și a aditivilor activatori poate fi reprezentat prin următoarele scheme:
În ceea ce privește activatorii cum ar fi halogenurile alchilice, de exemplu în sistem:
atunci formarea speciilor cationice inițiale este posibilă numai cu participarea monomerului:
Practic, numai acidul Lewis poate fi catalizat dacă este capabil să formeze o pereche de ioni:
În plus față de inițiatorii de polimerizare cationici menționați mai sus, este posibil să se utilizeze I2. Cu 2+. precum și radiații de mare energie. Efectul catalitic al iodului se bazează pe următoarele transformări:
Astfel, HI acționează ca un activator în ceea ce privește I2. Ionul Cu 2+ inițiază polimerizarea fie prin oxidarea legăturii π (trecerea electronului de la monomer la Cu 2+), fie prin legarea π.
Pentru sărurile de carboniu este posibil un mecanism de inițiere constând în transferul unui electron de la monomer la cation, formând un radical liber și un cation radical al monomerului:
Radicalii liberi formați în cadrul acestei scheme sunt foarte stabili și nu ar trebui luați în considerare ca agenți de inițiere.
Terminarea lanțului în polimerizarea cationică este mult mai importantă decât în procesul anionic. În cazul polimerizării anionice, este posibil să se creeze condiții pentru creșterea continuă a lanțurilor și păstrarea pe termen lung a concentrației constante de macromolecule "vii"; acest lucru permite de multe ori "revitalizarea" procesului prin introducerea de cantități suplimentare de monomeri și, prin urmare, creșterea lungimii lanțurilor.
În polimerizarea cationică, durata de viață a siturilor active este în general scăzută. În cazul polimerizării cationic, de exemplu, stiren și izopren, este principala cauză a formării produselor cu un grad de polimerizare care nu depășește 50. proprietate comună -MnM + tip sitelor active este tendința spre stabilizare prin îndepărtarea unui proton capturarea orice anion sau izomerizare mai stabil de stat. Prin urmare, posibilitatea de a forma un polimer înalt sub inițiere cationic este definită de procesele de creștere și stabilizarea centrilor activi. Luați în considerare reacțiile de terminare a circuitului și de transfer de lanț în polimerizarea cationică:

Astfel, în polimerizarea izobutilenei în prezența H + [BF3OH] - aceste reacții de terminare și transfer de lanț (cu excepția (1.b)) se efectuează după cum urmează:
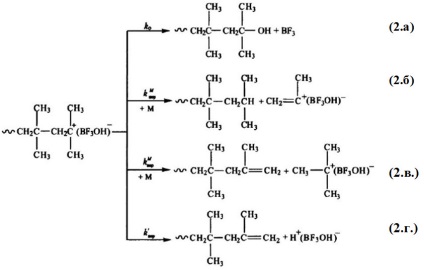
Reacțiile (2.b) și (2.c) cinetic pot fi distinse, dar primele rezultate în formarea unui fragment terminal de catenă saturată, iar al doilea - nesaturat precum și reacția (2.d.). Marcat trei reacții sunt similare, în care, ca rezultat al circuitului lor de curgere cinetică nu este tăiat, și fiecare particulă complex „inițiator - activator“ ( „inițiator - monomer - activator“) este capabil să înceapă o creștere a unui nou lanț.
Un exemplu de formare a unei legături covalente la reacția cu un contraion (reacția (1.b)) este terminarea lanțului în polimerizarea stirenului cu acid trifluoracetic:
Reacția de transfer al lanțului la monomer nu afectează viteza de polimerizare, dar ajută la controlul lungimii macromoleculei polimerice, i. E. un polimer cu o distribuție a greutății moleculare înguste.
În plus față de transferul lanțului în monomer, sunt posibile și reacții de transfer la solvent, impurități sau substanțe introduse în mod special:
Transmițătoarele CA pot fi apă, alcooli, acizi, anhidride, eteri și esteri, amine și alți compuși.
Mulți dintre agenții de transfer de lanț (apă, alcooli) sunt adesea folosite ca activatori, prin urmare, utilizarea lor în cantități care depășesc suma echivalentă în raport cu inițiator poate duce la o creștere a proporției proceselor de transfer de lanț și la o scădere a greutății moleculare.
Vitezele etapelor individuale pot fi scrise sub forma:
Formarea ionului de carboniu
Potențialul de ionizare (energia de ionizare) I este definit ca energia necesară pentru îndepărtarea unui electron dintr-o moleculă sau atom în fază gazoasă:
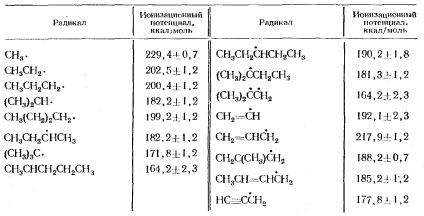
Potențialul de ionizare al radicalilor alchilici este dat în Tabelul 2.
Tabelul 2. Potențialul de ionizare al radicalilor alchil
O comparație a ionizării radicalilor metil și etil este prezentată în Fig. 2.
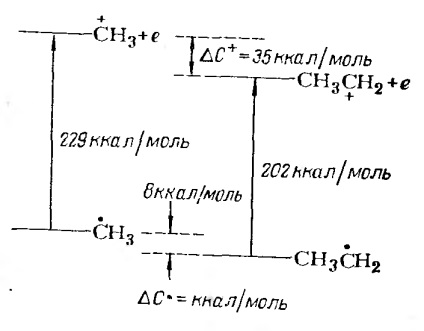
Figura 2. Compararea potențialelor de ionizare pentru radicalii metil și etil. Energia de stabilizare a ionului carboniu # 916; C + și radical # 916;
Stabilizarea carboniu ion gruparea metil este de 147 kJ / mol (35 kcal / mol), în timp ce, ca stabilizarea radicalului printr-o grupare metil este de 33,6 kJ / mol (8 kcal / mol).
Proton Afinitate
Este important să se evalueze bazicitatea diferitelor olefine în sensul afinității pentru proton și ionul de carbon în conformitate cu ecuațiile:
Afinitatea olefinelor pentru un proton este determinată de următoarele patru etape:
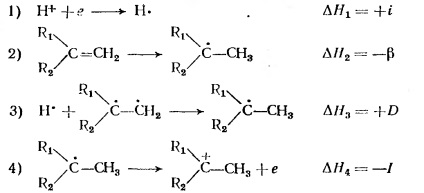
Aici, i, afinitatea protonului la electron, este definită ca fiind reciprocă a potențialului de ionizare al atomului de hidrogen; # 946; - energia dezvăluirii dublei legături; D este energia de legătură C-H; I este potențialul de ionizare al radicalului format la adăugarea atomului de hidrogen la olefină.
Pentru orice olefină asimetrică, afinitatea pentru proton va depinde de atomul de carbon la care este atașat. Datele pentru etilenă, propilenă și izobutilenă sunt prezentate în tabelul 3.
Tabelul 3. Afinitatea unui proton și a unui atom (kcal / mol) la olefine
Afinitatea pentru ionul de carboniu (C1 și C2, respectiv, ca P1 și P2) variază, de asemenea, ca P1 afinitate de protoni (și în mod corespunzător C1) și a crescut semnificativ de la etilenă la izobutilenă. Aceasta explică faptul că reactivitatea etilenei este crescută, care nu este activ cationici catalizatori izobutilenei, care are o activitate ridicată. Așa cum se poate observa din Tabelul 3, scăderea potențialului de ionizare a radicalului cauzează o creștere a afinității pentru proton.
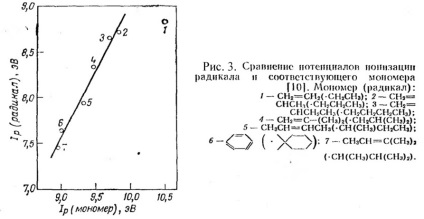
Figura 3 arată că potențialul de ionizare al radicalului și al monomerului este legat de o relație liniară.
2.2.4. Modificarea energiei libere în formarea ionului de carboniu
Stabilitatea ionului trebuie să fie legată de schimbarea energiei libere în timpul formării sale.
Tabelul 4. Entalpia ionizării în faza gazoasă
R - Br → R + + Br - (energii de disociere a legăturilor heterolitice)
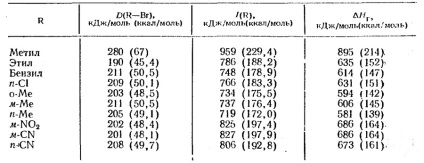
Cu toate acestea, pentru formarea ionilor de carboniu din halogenurile alchilice în faza gazoasă, sunt cunoscute numai valorile entalpiei, care este determinată din datele de măsurare a impactului cu electroni și, prin urmare, este derivatul energiei de disociere heterolitică. Deoarece schimbările corespunzătoare în entropie sunt mici, în principiu este posibilă estimarea modificării energiei libere printr-o schimbare a entalpiei (Tabelul 4.)
Energia necesară pentru a disocia halogenura de alchil RX în ionii R + și X. poate fi reprezentată ca sumă a schimbării energiei în trei etape ipotetice:
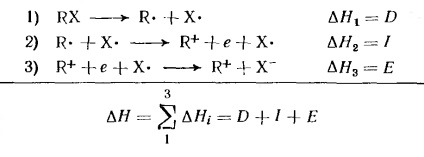
valoare H1 este energia disocierii homolitic a legăturii; H2 este potențialul de ionizare al radicalului alchil; Afinitatea H3 pentru electronul atomului X (independent de natura alchilului). Potențialele de ionizare a radicalilor alchilici și # 916; H halogenuri în formarea de ioni de carbon sunt date în tabelul 4. Aceste date sunt separate complet ioni în fază gazoasă. După cum se poate observa din tabelul 4, energia de disociere a compușilor alchil și potențialele de ionizare depind brusc de natura R. Formarea ionilor gazoși prin carboniu Heterolysis molecule neutre este consumatoare de energie și, prin urmare, rareori observate experimental.
Reacțiile organice, inclusiv formarea ionului carboniu în soluție, sunt mult mai frecvente.
Reacțiile ionului carboniu din soluție includ în mod necesar solvatarea ionică. Interacțiunea cu solventul stabilizează ionul de carboniu și contraionul său. Deoarece stabilizarea este legată în primul rând de prezența încărcărilor electrice, formele ionizate vor fi mai bine solvate decât cele neionizate. Toți solvenții contribuie la o anumită solvatare (comparativ cu faza gazoasă).
Schema de ionizare RX molecule organice în fază gazoasă și în soluție este prezentată în Figura 4. în cazul în care - o stare de tranziție de ionizare R + si X - - ionii separați.
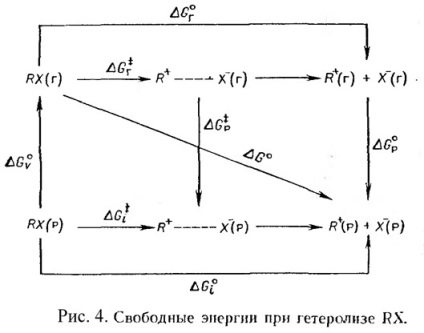
Este destul de evident că G 0 este schimbarea standard a energiei libere a formării de ioni în soluție din halogenura de alchil gazoasă - ar trebui exprimată ca sumă # 916; G 0 p + # 916; G 0 g. Rezultă din figura 4:
Energia liberă de solvație ionică este de obicei calculată dintr-o ecuație empirică, numită adesea ecuația Born. Schimbarea energiei libere atunci când ionul se mișcă cu o rază r și încărcarea e de la faza gazoasă la solvent (D) este:
Conform ecuației (11), energia de solvatare a ionului va fi mai mare în solvenții cu permitivitate dielectrică înaltă.
De asemenea, este importantă solvația și polarizabilitatea specifice. Aparent, o rază mică a ionilor solvatate ar trebui să fie mai bine, și este foarte adevărat pentru cationi anorganici. Rezultă că interacțiunea mai puternică între ionul și solventul are loc la o rază de ioni mică și mare valoare a permeabilității dielectrice a mediului.
Trimiteți-le prietenilor: