3.2.2. Aplicarea principiului de târâtor
Reacții organice. Să ilustrăm cum arată datele din tabel. 3.1 poate fi folosit pentru a prezice poziția de echilibru. Metanolul și iodura de metil pot fi reprezentate în mod formal ca produse de neutralizare a acidului moale CH3 + baze OH - (hard) și I - (moale). Apoi, pe bază HSAB principiu poate „prezice“ că echilibrul trebuie deplasat spre dreapta în reacția metanolului cu iodhidric, deoarece această conexiune sunt formate corespunzătoare interacțiunii „soft-soft“ și „hard-tare.“
Într-adevăr, constanta de echilibru este foarte mare: K »10 9 la 25 о С.
Într-o altă reacție dată mai jos, cationul acilic (CH3C + = 0, acidul tare) trece de la baza moale RS - la baza tare OH -. și prin urmare echilibrul "trebuie" să fie mutat spre dreapta:
Într-adevăr, experimentul arată că tioeterii reacționează foarte ușor cu apă și alcooli într-un mediu ușor alcalin.
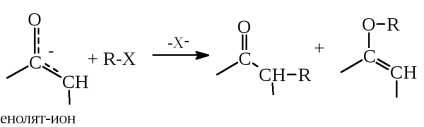
Principiul GICS este folosit pe scară largă în chimia organică și îl vom folosi în capitolele ulterioare ale acestei cărți. De exemplu, acest principiu este foarte util în descrierea căilor de reacții ale nucleofilelor ambigue, cum ar fi ionii enolați, cu agenți electrofili (capitolul 17):
precum și electrofilii ambidenți, de exemplu, compuși de carbonil a, b-nesaturați, cu nucleofili (Capitolul 16):
În primul caz, enolatul ion centru carbon nucleofil este mai moale decât oxigenul și, prin urmare, se obține produsul de alchilare de carbon de mai sus, în cazul în care „porțiunea acidă“ electrofil R-X (adică, R +) este un acid Lewis moale. În cea de-a doua reacție, cu atât este mai moale nucleofilul Y -. cu cât afinitatea este mai mare pentru centrul electrofilic mai moale - atomul de carbon b, mai degrabă decât pentru carbonilul mai rigid. Prin urmare, pentru nucleofilii moi, adăugarea legăturii C = C la atomul b crește (reacția Michael, vezi capitolul 16).
Simbioza. Pe rigiditatea și moliciunea atomilor donor și acceptor în bazele și acizii, respectiv, afectează rigiditatea sau moliciunea substituenții prezenți în moleculă înainte de formarea aductului. Acest efect a fost numit "simbioză". Esența este că substituenții moi fac acizii și bazele mai moi, substituenții tari îi fac mai rigizi. De exemplu, [Co (NH3) 5F] 2+ este mai stabil decât [Co (NH3) 5] 2+. deoarece baza tare a NH3, ca atare, crește rigiditatea cobaltului, făcând-o mai predispusă la adăugarea de fluorură, mai degrabă decât iodură. Pe de altă parte, dacă amoniacul este înlocuit cu un ligand moale CN -. atunci stabilitatea este inversată: [Co (CN) 5]] 3 este stabilă și [Co (CN) 5F] 3 nu există.
Trimiteți-le prietenilor: