Momentul dipolului este electric, cantitatea vectorului care caracterizează asimetria distribuției este pozitivă. și negativă. încărcări într-un sistem neutru electric. Două taxe identice + q și -q formează încărcarea electrică. dipol cu diametrele m = q l, unde l este distanța dintre încărcări. Pentru un sistem de sarcini n, qi, a căror vectori ai razei sunt ri. În molecule și mol. centrele de sisteme vor. încărcările qA coincid cu pozițiile nucleelor atomice (vectori de rază-rA), iar distribuția electronilor este descrisă de densitatea de probabilitate r (r). În acest caz, vectorul DM este direcționat de la centrul de greutate la un punct negativ. încărcările către centrul de greutate al pozitivului. În chim. literatura de dinamică moleculară uneori atribuie direcția opusă. Deseori, introduceți ideea de DM ale chimiei individuale. legături, suma vectorului din care dă o moleculă algebrică. În acest sens, cuplajul diferențial este determinat de două valori pozitive. sarcinile nucleelor atomilor care formează o legătură, iar distribuția este negativă. (electronică). D.M. conexiunea se datorează schimbării norului de electroni către unul dintre atomi. Se numește comunicarea. polar dacă ecuația diferențială corespunzătoare este substanțial diferită de zero. Cazurile sunt posibile atunci când legăturile individuale din moleculă sunt polare, iar greutatea moleculară totală a moleculei este zero; astfel de molecule sunt numite. nepolar (de exemplu, moleculele de CO2 și CCI4). Dacă greutatea moleculară a moleculei este nenuloasă, se numește molecula polar. De exemplu. molecula H2O este polară; sumarea momentelor magnetice ale două legături polar OH dă de asemenea un magnetism diferențial nenulos îndreptat de-a lungul bisectorului unghiului de valență al HON. Ordinea de mărime a greutății moleculare a unei molecule este determinată de produsul încărcării electronice (1.6.10 -19 CI) prin lungimea chimică. (de ordinul 10 - 10 m), adică, este de 10 - 29 ° C. m. În literatura de specialitate, moleculele DM sunt conduse în Debye (D sau D), prin numele lui P. Debye; 1 D = 3,33564. 10 - 30 Cl. m. Spectroscopic. Metodele de determinare a moleculelor cu greutate moleculară se bazează pe efectele împărțirii și deplasării liniilor spectrale în linii electrice. (efectul Stark). Pentru moleculele liniare și molecule de tip de tip simetric, se cunosc expresii exacte care se referă la DM la divizarea Stark a liniilor de spectre de rotație. Această metodă oferă cele mai bune rezultate. Valorile exacte ale AD m. (10-4 D), și nu numai magnitudinea determinat experimental, ci și direcția vectorului m D. Este important ca precizia AD m este practic independentă de abs ei ... valoare. Aceasta a făcut posibilă obținerea unor valori foarte precise pentru DM foarte mici dintr-un număr de molecule de hidrocarburi, care nu pot fi determinate în mod fiabil prin alte metode. Deci, D. m. Propan este 0.085 b 0,001 D 0,002 0,364 Propilen b D b propină 0,780 0,001 D 0.375 toluen 0.01 b D b azulene 0,796 0,01 D. Aplicarea metodei microunde spectroscopie este limitată, totuși, molecule mici care nu conțin atomi de elemente grele. Direcția vectorului dinamicii moleculare a moleculei este m. Se determină experimental și în funcție de efectul Zeeman al ordinii a doua. Et al. un grup de metode pentru determinarea câmpurilor magnetice se bazează pe măsurătorile dielectrice. permeabilitatea e in-va. Aceste metode au fost folosite pentru a măsura moleculele DM mai mult de 10.000 in-in. Tranziția de la valoarea măsurată e a gazului, lichidului pur sau dil. p-ra, adică macroscopic. caracteristici dielectrice, la valoarea DM. se bazează pe teoria de polarizare dielectrică. Se crede că atunci când se aplică electric. câmp pe polarizarea dielectric total P (m. D. medie pe unitatea de volum) este compus dintr-o polarizare și orientare polarizare indusă sau indusă Pm și este asociată cu Rohr m ur-niem Langevin - Debye
unde M este un mol. masă, d este densitatea, a este polarizabilitatea moleculei, NA este numărul Avogadro, k este constanta Boltzmann și T este abs. temp. Măsurători ale dielectricului. permeabilitățile sunt realizate într-un câmp constant sau la frecvențe joase, care asigură orientarea completă a moleculelor pe câmp. Cu naib. O variantă comună a metodei - măsurători în diluție. p-rax al distribuitorilor nepolari - este presupusă aditivitatea polarizărilor substanței dizolvate și a solventului. O comparație a rezonanței magnetice a moleculelor polare ale anumitor org. Conn. obținută prin diferite metode, este prezentată în tabel.
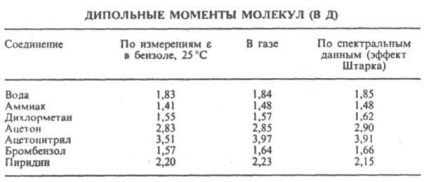
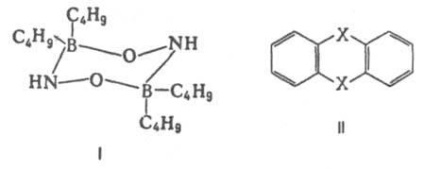
Cel mai important domeniu de aplicare a datelor DM. Blocurile structurale moleculare ale cercetării, stabilirea conformație moleculare, compoziția conformationala și izomerică în insule, dependența sa de r-ry. Valorile dinamicii moleculare a moleculelor fac posibilă judecarea distribuției densității electronice în molecule și dependența acestei distribuții de natura substituenților individuali. În cazul general, interpretarea structurală a ecuațiilor diferențiale necesită o comparație cu experimentul. valorile cu valorile obținute prin mecanica cuantică. calculul fie cu ajutorul unei scheme de vectori aditivi utilizând DM a legăturilor individuale și a grupurilor atomice. Acestea din urmă se găsesc fie în termeni de intensitate a oscilațiilor. benzile de absorbție sau prin descompunerea vectorilor de microscopie electronică a anumitor molecule simetrice. Calculele care utilizează schema de aditivi vectori pot lua în considerare diferențele. manifestări ale stereochimului. Ligiditatea, de exemplu. dificil sau gratuit. ext. rotația moleculei. Foarte simetric mol. structuri având un centru de inversie, două axe perpendiculare între ele de rotație sau axe perpendiculare pe planul de simetrie, nu ar trebui să aibă AD m. Conform prezenței sau absenței AD m. molecula poate, în unele cazuri, de a alege pentru ea o anumită structură fără K-L . teoretic. calcule. Astfel, experimentul este zero. Dimerul dimerului aminoxi-dibutilboranului (formula I) este dovada că există ca o conformație stabilă a scaunului cu un centru de inversiune. Pe de altă parte, prezența AD m. Y tiantren (formula II, X = S) și selenantrena (II, X = Se), egal cu 1,57 D și, respectiv, 1,41 D. exclude pentru ei o structură centrosymmetrică, în special, plat.
===
App. Literatură pentru articolul "DIPOLE MOMENT": Minkin VI Ossipov OA A. Zhdanov Yu. A. Momente ale dipolului în chimia organică. L. 1968; Osipov OA Minkin, VI Garnovskii, Manualul AD pe momentele dipolului, ed. M. 1971; Exner O. Momente de dipol în chimia organică, Stuttg. 1975. V. I. Munkin.
Pagina "DIPOLE MOMENT" este pregătită pe baza materialelor din enciclopedia chimică.
Articole similare
Trimiteți-le prietenilor: