Hidrocarburi nesaturate din seria de etilenă. sau alchene, sunt hidrocarburi cu formula generală CnH2n. ale căror molecule conțin o dublă legătură. Atomii C, legate printr-o legătură dublă, sunt în sp2 hibridizare, dubla legătură este o combinație de - și - legături. Prin natura sa - legătura este dramatic diferită de legătură; - conexiunea este mai puțin puternică datorită suprapunerii noriilor electronice în afara planului moleculei.
Cea mai simplă alchenă este etilenă. Formulele structurale și electronice pentru etilenă sunt:
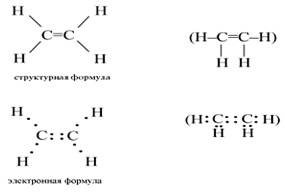
În molecula de etilenă, sunt hibridizate o s - și două p-orbitale ale atomilor C (sp2-hibridizare). Astfel, fiecare atom C are trei orbite hibride și un p-orbitale ne-hibride. Două dintre orbitele hibride ale atomilor C se suprapun și formează o legătură C între atomi. Celelalte patru orbite hibride de atomi C se suprapun în același plan cu patru s-orbite ale atomilor de H și formează și patru legături.
Două p-orbitale ne-hibride de atomi C se suprapun într-un plan care este perpendicular pe planul legăturii, adică se formează unul. Sub acțiunea reactivilor, legătura este ușor de rupt.
Etilena este primul membru al seriei omoloage de alchene.
Dar molecula 2 a butenei poate fi sub forma a două forme spațiale - cis- și trans-:
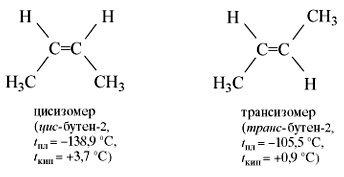
Izomerii Cis și trans, având un aranjament diferit de atomi în spațiu, diferă în multe proprietăți fizice și chimice. Astfel, două tipuri de izomeri structurali sunt posibile pentru alchene. izomerismul lanțului de carbon și izomerismul poziției duble a legăturii. Izomerismul geometric este, de asemenea, posibil. Etilenă (ethenă) este un gaz incolor, cu un miros foarte slab dulce, ușor mai ușor decât aerul, puțin solubil în apă.
Conform proprietăților sale chimice, etilenă diferă brusc de etan, care se datorează structurii electronice a moleculei sale. Având în moleculă o dublă legătură care constă din - și legături, etilena este capabilă să atașeze doi atomi sau radicali monovalenți din cauza ruperii.
Capacitatea de reacție de adiție este caracteristică pentru toate alchenele.
Atunci când bromul este adăugat la alchenă (sub formă de apă de brom), culoarea brună a bromului dispare rapid. Această reacție este calitativă pentru o dublă legătură.
Dacă alchenul inițial este asimetric, reacția se desfășoară conform regulii Markovnikov.
Adăugarea halogenurilor de hidrogen la compușii nesaturați are loc printr-un mecanism ionic.
4. Adăugarea apei (reacția de hidratare):
Această reacție este utilizată pentru a produce alcool etilic în industrie.
Alcanii sunt caracterizați prin reacții de oxidare:
1. Etilena este ușor oxidată deja la temperatura obișnuită, de exemplu sub acțiunea permanganatului de potasiu. Dacă etilenă este trecut printr-o soluție apoasă de permanganat de potasiu KMnO4. apoi culoarea violetă caracteristică a celor din urmă dispare, există o oxidare a etilenei cu permanganat de potasiu (o reacție calitativă la o dublă legătură):
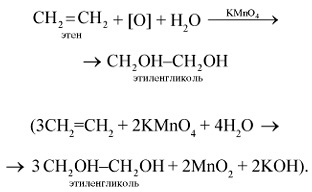
2. Etilena arde cu flacără luminată pentru a forma monoxid de carbon (IV) și apă:
3. Oxidarea parțială a etilenei cu oxigenul din aer are o mare importanță industrială:
Pentru etilenă, ca și pentru toate hidrocarburile nesaturate, reacțiile de polimerizare sunt caracteristice. Acestea apar la temperaturi ridicate, presiune și în prezența catalizatorilor:
Polimerizarea este o combinație secvențială de molecule identice în cele mai mari.
Astfel, etilenă și omologii săi se caracterizează prin reacții de adiție, oxidare și polimerizare.
Articole similare
-
Obligațiile generale ale atamanilor (comandanții) diviziunilor cazaci - stadopedia
-
Reguli de siguranță pentru lucrul în laboratorul de inginerie electrică generală - stadopedia
Trimiteți-le prietenilor: