1. Prima lege a termodinamicii și ecuația echilibrului termic
Până în prezent am considerat prima lege a termodinamicii în ceea ce privește gazele. O caracteristică distinctivă a gazului este că volumul său poate varia considerabil. Prin urmare, în conformitate cu prima lege a termodinamicii, cantitatea de căldură Q transferată la gaz este egală cu suma lucrărilor realizate de gaz și schimbarea energiei sale interne:
În această secțiune vom examina cazurile în care o anumită cantitate de căldură este raportată unui corp lichid sau solid. Atunci când sunt încălzite sau răcite, acestea variază nesemnificativ în volum și, prin urmare, ele sunt de obicei neglijate atunci când sunt extinse. În consecință, pentru lichide și solide prima lege a termodinamicii poate fi scrisă sub formă
Simplitatea acestei ecuații este, totuși, înșelătoare.
Faptul este că energia internă a corpului este doar energia cinetică totală a mișcării haotice a particulelor sale constitutive numai atunci când acest corp este un gaz ideal. În acest caz, după cum deja știm, energia internă este direct proporțională cu temperatura absolută (§ 42). În lichide și solide, energia potențială a interacțiunii particulelor joacă un rol important. Și, după cum arată experiența, se poate schimba chiar și la o temperatură constantă!
De exemplu, în cazul în care o cantitate de transfer de căldură de apă rece ca gheața, temperatura va rămâne constantă (egală cu 0 ° C) până când toată gheața sa topit. (. Din acest motiv, că temperatura de topire a gheții și a primit la un moment dat ca punct de referință pentru a determina scara Celsius) Această căldură de intrare este consumat pentru a crește energia potențială de interacțiune moleculară: să se transforme într-un cristal lichid, este necesar să se cheltuiască energia pe distrugerea rețelei cristaline.
Un fenomen similar are loc la punctul de fierbere, în cazul în care o cantitate de apă de transfer termic la temperatura de fierbere, temperatura va rămâne constantă (egală cu 100 ° C la presiune atmosferică normală) până când apa se fierbe afară. (Pentru că și selectat ca un al doilea punct de referință pentru scara Celsius). In acest caz, căldura de intrare, de asemenea, este consumată pentru a crește energia potențială a interacțiunii moleculelor.
Se poate părea ciudat că energia potențială a interacțiunii moleculelor într-o pereche este mai mare decât în apă. La urma urmei, moleculele de gaz aproape nu interacționează unul cu altul, astfel încât energia potențială a interacțiunii lor este în mod natural luată ca nivel zero. Și ei o fac. Dar atunci energia potențială a interacțiunii moleculelor în lichid trebuie considerată negativă.
Un astfel de semn al energiei potențiale de interacțiune este caracteristic pentru atragerea de corpuri. În acest caz, pentru a mări distanța dintre corpuri, trebuie să se efectueze o muncă, adică să se mărească energia potențială a interacțiunii lor. Și dacă după aceea devine egal cu zero, înainte de asta a fost negativ.
Astfel, schimbarea stării lichidelor și a solidelor atunci când o anumită cantitate de căldură este transferată trebuie să fie luată în considerare luând în considerare posibilitatea schimbării stării lor agregate. Modificările în starea agregată sunt numite tranziții de fază. Este transformarea unui solid într-un lichid (topire), un lichid într-un solid (solidificare sau cristalizare), lichid în vapori (vaporizare) și vapori în lichid (condensare).
Legea conservării energiei în fenomenele termice cu lichide și solide se numește ecuația echilibrului termic.
Să considerăm mai întâi ecuația echilibrului termic pentru cazul în care are loc schimbul de căldură între cele două organisme, și schimbul lor de căldură cu alte organisme pot fi neglijate (calorimetre experimental pentru a crea astfel de condiții sunt utilizate - Containere care furnizează izolație pentru detalii).
Să luăm în considerare (așa cum am presupus mai devreme pentru gaze) cantitatea de căldură transferată corpului să fie pozitivă, dacă, prin urmare, energia internă a corpului crește și negativă dacă energia internă scade. În acest caz, ecuația de echilibru termic are forma
unde Q1 este cantitatea de căldură transferată la primul corp de pe a doua parte și Q2 este cantitatea de căldură transferată către cel de-al doilea corp din partea primului.
Se poate vedea din ecuația (1) că, dacă un corp primește căldură, un alt corp îl dă. De exemplu, dacă Q1> 0, atunci Q2 <0.
Dacă schimbul de căldură are loc între n corpuri, ecuația de echilibru termic are forma
2. Ecuația de echilibru termic fără tranziții de fază
Vom considera că organismul este omogen, adică constă în întregime dintr-o substanță (de exemplu, o anumită masă de apă, oțel sau bara de cupru etc.). Considerăm mai întâi cazul în care starea agregată a organismului nu se schimbă, adică nu există o tranziție de fază.
Desigur, fizica școală de bază știți că, în acest caz, transmise de caldura corpului Q este direct proporțională cu corpul m de masă și o schimbare de temperatură At:
În această formulă, ambele Q și Δt pot fi fie pozitive, fie negative.
Cantitatea c care intră în această formulă se numește căldura specifică a substanței din care este compus organismul. De obicei, ecuația de temperatură este folosită pentru ecuația de echilibru termic utilizând scara Celsius. Vom face și asta.
1. Figura 48.1 prezintă graficele dependenței de temperatură a două corpuri de cantitatea de căldură Q transferată la acestea. Masa fiecărui corp este de 100 g.
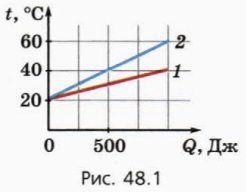
a) Care organism are o capacitate specifică de căldură și de câte ori?
(b) Care este căldura specifică a fiecărui corp?
2. Un calorimetru care conține 150 g de apă la o temperatură de 20 ° C imersează cilindrul metalic luat din apa fiartă. Căldura specifică a apei este de 4,2 kJ / (kg * K). Acceptați că pierderile termice pot fi neglijate.
a) Explicați de ce ecuația
unde cm și CB - valori ale capacității calorice a metalului și a apei, respectiv iM și MW - valori ale masei cilindrului și apă, respectiv, tc - valoarea finală a temperaturii calorimetrului a conținutului atunci când echilibrul termic este stabilit în acesta.
b. Care dintre cei doi termeni din formula de mai sus este pozitiv și care este negativ? Explicați-vă răspunsul.
c) Care este căldura specifică a unui metal dat dacă masa buteliei este de 100 g și temperatura finală este de 25 ° C?
d) Care este temperatura finală dacă cilindrul este fabricat din aluminiu și masa acestuia este de 100 g? Capacitatea specifică de căldură a aluminiului este de 0,92 kJ / (kg * K).
e) Care este masa cilindrului egală cu, dacă este fabricată din cupru și temperatura finală este de 27 ° C? Capacitatea specifică de căldură a cuprului este de 0,4 kJ / (kg * K).
Să luăm în considerare cazul când energia mecanică trece în energia internă. Fizicianul englez J. Joule a încercat să măsoare cât de fierbinte ar fi apă în cascadă când a lovit terenul.
3. La ce înălțime ar trebui să cadă apa, astfel încât, când atinge solul, temperatura să crească cu 1 ° C? Acceptați că jumătate din energia sa potențială trece în energia internă a apei.
Răspunsul pe care îl primiți va explica de ce un om de știință a eșuat. Luați în considerare faptul că omul de știință a pus experimentele acasă, unde înălțimea celei mai înalte cascade este de aproximativ 100 m.
Dacă corpul este încălzit de un încălzitor electric sau prin arderea combustibilului, trebuie luată în considerare eficiența încălzitorului. De exemplu, dacă eficiența încălzitorului este de 60%, aceasta înseamnă că creșterea energiei interne a corpului încălzit este de 60% din căldura eliberată atunci când combustibilul arde sau când încălzitorul electric funcționează.
Rețineți, de asemenea, că atunci când ardeți carburantul cu masa m, cantitatea de căldură Q este eliberată, exprimată prin formula
unde q este căldura specifică de ardere.
4. Pentru a aduce 3 litri de apă în fierbător de la o temperatură de 20 ° C până la fierbere, turiștii au trebuit să ardă în foc 3 kg de lemn peri uscați. Care este eficiența unui incendiu ca dispozitiv de încălzire? Căldura specifică de ardere a lemnului de foc este considerată egală cu 107 J / kg.
5. Folosind un încălzitor electric, încercați să aduceți 10 litri de apă la fierbere, dar apa nu fierbe: când încălzitorul este pornit, temperatura rămâne constantă, sub 100 ° C. Puterea încălzitorului 500 W, randament 90%.
a) Câtă cantitate de căldură este transferată pe 1 cu apă din încălzitor?
b) Cât de multă cantitate de căldură este transferată pe secundă de la apă la aerul înconjurător atunci când încălzitorul este pornit, când temperatura apei rămâne constantă?
c) Câtă cantitate de căldură va transfera apa în 1 minut la aerul din jur imediat după oprirea încălzitorului? Considerati ca in acest timp temperatura apei nu se va schimba semnificativ.
d) Cât va scădea temperatura apei timp de 1 minut imediat după oprirea încălzitorului?
3. Ecuația echilibrului termic în prezența tranzițiilor de fază
Să ne amintim câteva fapte cunoscute de la cursul de fizică al școlii principale.
Pentru a se topi complet solidul cristalin la temperatura de topire, este necesar să-l informeze din cantitatea de Q căldură, proporțională cu masa corpului m:
Coeficientul de proporționalitate λ este denumit căldura specifică de fuziune. Este numeric egală cu cantitatea de căldură necesară pentru a informa masa corporală cristalină a 1 kg, la o temperatură de topitură, în scopul de a se transforma complet într-un lichid. Unitatea de căldură specifică de fuziune este de 1 J / kg (joule pe kilogram).
De exemplu, căldura specifică de topire a gheții este de 330 kJ / kg.
6. La ce înălțime ar putea fi ridicat un om cu o masă de 60 kg dacă energia lui potențială este mărită cu o cantitate numerică egală cu cantitatea de căldură necesară pentru a topi 1 kg de gheață la o temperatură de 0 ° C?
La rezolvarea problemelor este important să se ia în considerare faptul că solidul va începe să se topească numai după ce acesta sa încălzit până la temperatura de topire. Pe graficul dependenței temperaturii corpului de cantitatea de căldură transferată, procesul de topire este un segment orizontal.
7. Figura 48.2 prezintă un grafic al dependenței de temperatură a greutății corporale de 1 kg față de cantitatea de căldură transferată.
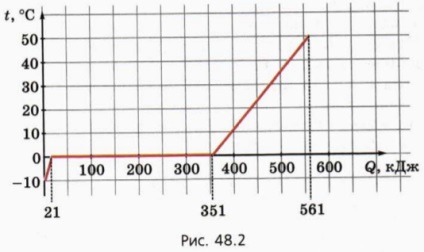
a) Care este căldura specifică a corpului în stare solidă?
(b) Care este punctul de topire?
c) Care este căldura specifică de fuziune?
d) Care este căldura specifică a corpului în stare lichidă?
e) De ce substanță se compune un anumit organism?
8. Un meteorit de fier intră în atmosfera Pământului. Capacitatea specifică de căldură a fierului este de 460 J / (kg * K), punctul de topire este de 1540 ° C, căldura specifică de fuziune este de 270 kJ / kg. Temperatura inițială a meteoritului înainte de a intra în atmosferă este -260 ° C. Să presupunem că 80% din energia cinetică a unui meteorit atunci când se deplasează prin atmosferă trece în energia sa internă.
a) Care ar trebui să fie viteza inițială minimă a meteoritului, astfel încât să se încălzească până la punctul de topire?
(b) Care parte a meteoritului se va topi dacă viteza sa inițială este de 1,6 km / s?
Dacă în prezența tranzițiilor de fază este necesară găsirea temperaturii corporale a corpurilor, atunci mai întâi este necesar să aflăm care va fi starea finală. De exemplu, dacă în starea inițială sunt date masele de gheață și apă și valorile temperaturilor lor, adică trei posibilități.
În starea finală, numai gheață (aceasta poate fi dacă temperatura inițială a gheții a fost suficient de scăzută sau masa de gheață a fost suficient de mare). În acest caz, temperatura necunoscută este temperatura finală a gheții. Dacă problema este rezolvată corect, valoarea obținută nu depășește 0 ° С. Când este stabilit echilibrul termic, gheața este încălzită până la această temperatură finală și toată apa este răcită la 0 ° C, apoi înghețată și gheața formată din ea este răcită până la temperatura finală (dacă este sub 0 ° C).
În starea finală, gheața și apa sunt în echilibru termic. Acest lucru este posibil numai la o temperatură de 0 ° C. O cantitate necunoscută în acest caz va fi masa finală de gheață (sau masa finală de apă: suma masei de apă și gheață este dată). Dacă problema este rezolvată corect, atunci masele finale de gheață și apă sunt pozitive. În acest caz, când se stabilește echilibrul termic, gheața este mai întâi încălzită la 0 ° C și apa este răcită la 0 ° C. Apoi, fie o parte din gheață se topește, fie o parte din apă îngheață.
În starea finală numai apă. Apoi, o cantitate necunoscută este temperatura (aceasta nu trebuie să fie mai mică de 0 ° C), în acest caz, apa este răcită la o temperatură finală și gheață trebuie să treacă printr-un traseu mai complicat: mai întâi el întreg este încălzit la 0 ° C, apoi întreaga dezghetul, și apoi se formează apa este încălzită la temperatura finală.
Pentru a determina care dintre aceste oportunități se realizează într-o anumită sarcină, este nevoie de un mic studiu.
9. Se adaugă o bucată de gheață la calorimetrul care conține 1,5 litri de apă la o temperatură de 20 ° C la -10 ° C. Acceptați că pierderile termice pot fi neglijate. Căldură specifică de gheață de 2.1 kJ / (kg * K).
a) Care ar putea fi masa gheții dacă în starea finală numai gheața este în calorimetru? doar apă? gheață și apă în echilibru termic?
b) Care este temperatura finală, dacă masa inițială de gheață este de 40 kg?
c) Care este temperatura finală, dacă masa inițială de gheață este de 200 g?
d) Care este masa finală de apă dacă masa inițială de gheață este de 1 kg?
Faptul că este necesar să se informeze o anumită cantitate de căldură pentru topirea corpului pare să fie naturală. Acest fenomen ne servește un serviciu bun: încetinește topirea zăpezii, reducând inundațiile în primăvară.
Dar faptul că, în timpul cristalizării, corpul dă o anumită cantitate de căldură, poate surprinde: nu apa dă cu adevărat o căldură când se îngheață? Și totuși este așa: înghețarea și transformarea în gheață, apa dă o cantitate destul de mare de căldură aerului rece sau gheții, a căror temperatură este sub 0 ° C. Acest fenomen ne servește și un serviciu bun, care atenuează primele înghețuri și debutul iernii.
Luăm acum în considerare posibilitatea transformării unui lichid în vapori sau vapori într-un lichid.
După cum știți din cursul de bază al fizicii școlare, cantitatea de căldură Q necesară pentru a transforma lichidul în abur la o temperatură constantă este proporțională cu masa m a lichidului:
Coeficientul de proporționalitate L se numește căldura specifică de vaporizare. Este numeric egal cu cantitatea de căldură, care trebuie raportată la 1 kg de lichid pentru ao transforma complet în abur. Unitatea de căldură specifică de vaporizare este de 1 J / kg.
De exemplu, căldura specifică de vaporizare a apei la punctul de fierbere și presiunea atmosferică normală a aerului este de aproximativ 2300 kJ / kg.
10. În calorimetru, în care există 1 litru de apă la o temperatură de 20 ° C, se introduc 100 g de vapori de apă la o temperatură de 100 ° C Care va fi temperatura in calorimetru dupa stabilirea echilibrului termic? Pierderile termice pot fi neglijate.
Întrebări și sarcini suplimentare
11. Pentru a încălzi o anumită masă de apă pe sobă de la 20 ° C până la punctul de fierbere, a durat 6 minute. Cât timp va dura toată apa să fiarbă? Acceptați că pierderea de căldură poate fi neglijată.
12. Într-un calorimetru care conține gheață cu o masă de 100 g la o temperatură de 0 ° C, aburul este admis la o temperatură de 100 ° C. Care va fi masa de apa in calorimetru egala cu atunci cand toata gheata se topeste si temperatura apei este 0 ° C?
13. Cubul de aluminiu încălzit a fost plasat pe un platou de gheață plat, a cărui temperatură era de 0 ° C. La ce temperatură era cubul încălzit, dacă era complet scufundat în gheață? Acceptați că pierderea de căldură poate fi neglijată. Capacitatea specifică de căldură a aluminiului este de 0,92 kJ / (kg * K).
14. Gloanțul de plumb lovește placa de oțel și se oprește. Temperatura gloantei înainte de impact este de 50 ° C, viteza este de 400 m / s. Viteza glonțului după impact este de 100 m / s. Ce parte a glonțului sa topit, dacă 60% din energia cinetică pierdută a trecut în energia internă a glonțului? Căldură specifică de plumb 0,13 kJ / (kg * K), punct de topire 327 ° C, căldură specifică de fuziune de 25 kJ / kg.
Articole similare
Trimiteți-le prietenilor: