Supercoolizarea este fenomenul formării unei stări metastabile a unui lichid răcit sub punctul de topire al fazei solide corespunzătoare. Temperatura de solidificare poate coincide cu punctul de topire numai cu răcire lentă în prezența unei faze solide.
lichid racim poate exista un timp nelimitat, fără modificări, în cazul în care nu apare „embrion“ în fază solidă. O condiție necesară pentru nuclearea unui cristal și creșterea acestuia din topitură este supracoolizarea topiturii. Cu toate acestea, se distinge Subracire necesar pentru cristal să crească de la subrăcire necesară pentru centrul de cristal nucleația. Dacă temperatura de cristalizare definim ca temperatura la care începe creșterea cristalelor într-un lichid care urmează să fie răcit, temperatura la care a început cristalizarea, va continua, va fi puțin diferită de temperatura de cristalizare, cel mai important lucru este că această temperatură au avut tendința să scadă deoarece fără această condiție, adică. e. doar la temperatura de cristalizare, cristalul va fi în echilibru cu topitură. Situația este diferită cu începutul cristalizării, adică. E. In absenta embrionului finit sau semințe.
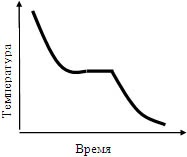
Fig. 1.2. Comportamentul temperaturii în timpul răcirii topiturii fără supracolire
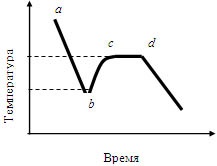
Fig. 1.3. Comportamentul temperaturii în timpul răcirii topiturii cu răcire superioară
Din punct de vedere modern, lichidul la temperatura de solidificare este mai aproape de structura cristalului decât de structura vaporilor. Când lichidul este răcit, este în mare măsură pregătit pentru trecerea la o stare solidă. Acesta conține un număr semnificativ de clustere cu un aranjament orientat de molecule ca o latură de cristal. Cu toate acestea, aceste clustere sunt într-o stare instabilă.
Numeroase studii arată că pe suprafețele solide la limită, moleculele lichide sunt adsorbite și formează straturi subțiri de suprafață cu molecule de fluid orientate într-un anumit mod. Aceste straturi de graniță nu sunt doar cele mai favorabile locuri pentru nuclearea centrelor de cristalizare, ci și ele sunt singurele posibile. În consecință, aceasta implică faptul că, pentru ca nuclearea să aibă loc, o condiție necesară este prezența unei faze solide și prezența unui strat anizotrop de molecule lichide la această limită.
Dacă faza solidă aparține aceleiași substanțe ca topirea, cristalizarea continuă de-a lungul întregii interfețe. Dacă faza solidă aparține unei alte substanțe, atunci cristalizarea are loc numai în puncte separate. Dacă nu este în faza lichidă suprarăcit în pereți forma cristalină solide sau particule în suspensie și fără straturi anizotrope asemănătoare cu o structură a cristalelor, lichidul poate chiar pierde capacitatea de a subrăcire.
Formarea de centre de cristalizare este facilitată de particule solide străine suspendate în soluție sau într-o topitură. Experimentele arată că semințele care sunt centre de cristalizare pot fi 1) particule de substanță cristalizantă; 2) particule de alte substanțe și izomorf cu substanța cristalizantă și formând soluții solide cu aceasta; 3) particule de substanțe care dau splicuri regulate substanței cristalizante; 4) particule de substanțe care pe moleculele lor de adsorbție de suprafață ale substanței cristalizante.
Deoarece suprafețele solide nu sunt niciodată omogene, secțiunile individuale au activități diferite în ceea ce privește formarea unei noi faze. Această activitate este determinată atât de natura fizico-chimică a sitului, cât și de forma și magnitudinea sa geometrică. Două cazuri de acțiune de activare a suprafeței cristaline trebuie distinse. Suprafețele de minerale și alte substanțe cristaline pot determina formarea de centre de cristalizare prin acțiunea de orientare a rețelei cristaline intrinseci. În acest caz, cristalul nou născut este întotdeauna orientat într-un anumit mod relativ la grâul cristalului pe care acesta a provenit. Există o serie de studii care demonstrează că în acest caz trebuie să existe o anumită relație între forma și mărimea celulelor unice ale cristalelor.
Impuritățile insolubile joacă un rol foarte important în cristalizarea din topitură și din soluție. Acestea sunt centrele în jurul cărora cresc cristalele. Cantitatea acestor impurități străine depinde de structura lingoului care rezultă din solidificarea topiturii. Cu cat sunt mai multe impuritati, cu atat mai mult pot exista centre de cristalizare, cu atat structura lingoului este mai mica, adica mai mici sunt granulele sau cristalizatele. Proprietățile mecanice ale metalelor pure și ale aliajelor depind de structura lor. Cu cât structura este mai mică, cu atât sunt mai mari calitățile mecanice ale metalului.
Nu toate impuritățile insolubile sunt centrele de cristalizare. Aceste impurități care au aceeași latură cristalină ca o substanță topită sau dizolvată, servesc ca centre de încredere de cristalizare. Impuritățile izomorfe sunt, în primul rând, embrioni. Cu toate acestea, cristalizarea aproape de un perete solid este mai ușoară chiar dacă nu este izomorf cu substanța topită. Prin urmare, se poate aștepta ca majoritatea impurităților să afecteze nuclearea cristalelor.
Articole similare
Trimiteți-le prietenilor: