Diagrama atomului de oxigen
Cu toate acestea, Priestley nu a realizat inițial că a descoperit o nouă substanță simplă. el a crezut că a desemnat una din părțile componente ale aerului (și a numit acest gaz "aerul dephlogistic"). Despre descoperirea sa Priestley ia informat pe chimistul francez Antoine Lavoisier. În 1775, A. Lavoisier a stabilit că oxigenul este parte integrantă a aerului, acizilor și este conținut în multe substanțe.
Astfel, meritul descoperirii oxigenului divide de fapt Priestley, Scheele și Lavoisier.
Originea numelui
oxigen Word (numit la începutul secolului al XIX-lea încă „kislotvorom“) la apariția sa în limba rusă este necesară pentru a Lomonosov - un plan al termenului „Oxygen“ (Pr l'oxygène.), propusă de Lavoisier (de la ὀξύς όξύγενναω grecesc - « acru „și γενναω -« născut «), care este tradus ca» generator de acidul «care este legată de valoarea sa inițială -» acidă“, oxizi implicit anterior, denumit în continuare de curent oxizi nomenclatura internațională.
Fiind în natură
În prezent, oxigenul este produs din aer în industrie. In laboratoare, oxigenul industrial sunt furnizate în cilindri de oțel sub o presiune de aproximativ 15 MPa. Cea mai importantă metodă de laborator a producției sale este electroliza soluțiilor apoase de alcalii. Cantități mici de oxigen, pot fi de asemenea preparați prin reacția unei soluții de soluție de permanganat de potasiu acidulată cu peroxid de hidrogen. Plantele de oxigen sunt, de asemenea, bine cunoscute și utilizate cu succes în industrie. care funcționează pe baza membranei și azotic tehnologiy.Pri KMnO4 încălzire permanganat de potasiu se descompune K2 MnO4 manganat de potasiu și dioxid de mangan MnO2 cu degajare simultană de O2 gaz oxigen:
În condiții de laborator, acestea sunt obținute și prin descompunerea catalitică a peroxidului de hidrogen H2O2:
Catalizatorul este dioxid de mangan (MnO2) sau o bucată de legume crude (acestea conțin enzime care accelerează descompunerea peroxidului de hidrogen).
Oxigenul poate fi de asemenea obținut prin descompunerea catalitică a cloratului de potasiu (sare de berthollet) KClO3:
Catalizatorul este de asemenea Mn02.
Apa rece conține mai mult O2 dizolvat
Proprietăți fizice
În condiții normale, oxigenul este un gaz fără culoare, gust și miros. Acesta cântărește 1.429 g. Este puțin mai greu decât aerul. Puțin solubil în apă (4,9 ml / 100 g la 0 ° C, 2,09 ml / 100 g la 50 ° C) și alcool (2,78 ml / 100 g la 25 ° C). Se dizolvă bine în argintul topit (22 volume de O2 în 1 volum de Ag la 961 ° C). Este un paramagnet.
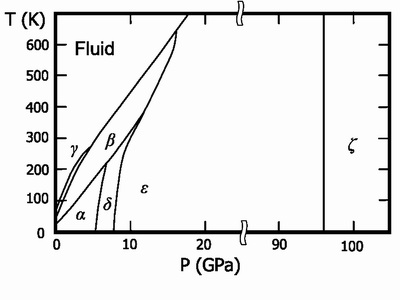
Oxigen solid (punct de topire -218,79 ° C) - cristale albastre. Șase faze cristaline sunt cunoscute. din care 3 există la o presiune de 1 atm.
- Temperatura a-O2 este sub -249,35 ° C, cristalele albastre strălucitoare, syngonia rombică. parametrii celulari a = 5,50 A, b = 3,82 A, c = 3,44 A;
- β-O2 temperatura -249.35--229.35 ° C, cristale albastru pal, culoarea atunci când presiunea devine sistem roz, cristal romboedric, a = 6,19Å, α = 99 ° 6;
- Temperatura y-O2 de la -229,35 la -218,79 ° C, cristalele de culoare albastru deschis, syngonia cubică, a = 6,83 Å;
Alte trei faze se formează la presiuni mari:
- Intervalul de temperatură Δ-O2 până la 300 K și presiunea 6-10 GPa. cristalele portocalii;
- presiunea ε-O2 de la 10 la 96 GPa, culoarea cristalelor de la roșu închis la negru, syngonie monoclinică;
- Presiunea z-O2 de peste 96 GPa, o stare metalică cu un luciu metalic caracteristic, se transformă într-o stare superconductoare la temperaturi scăzute.
Proprietăți chimice
- Oxidant puternic, interacționează, practic, cu toate elementele, formând oxizi. Gradul de oxidare -2. De regulă, reacția de oxidare are loc cu eliberarea căldurii și accelerează cu creșterea temperaturii. Exemplu de reacții care au loc la temperatura camerei:
- oxidizează compușii care conțin elemente cu o stare maximă de oxidare:
- oxidează majoritatea compușilor organici:
- în anumite condiții, este posibil să se efectueze o oxidare "blândă" a compusului organic:
- Oxigenul nu oxidează Au și Pt. halogeni și gaze inerte.
- Oxigenul formează peroxizi cu o stare de oxidare de -1.
- de exemplu, peroxizii sunt produși prin arderea metalelor alcaline în oxigen:
-
- pe teoria arderii dezvoltată de AN Bach și Engler, oxidarea are loc în două etape, cu formarea unui compus intermediar peroxid. Acest intermediar poate fi distins, de exemplu, când flacăra de hidrogen ars este răcită de gheață, împreună cu apă, se formează peroxid de hidrogen:
- Supperoxidurile au o stare de oxidare de -1/2, adică un electron la doi atomi de oxigen (ion O2 -). Obținut prin interacțiunea dintre peroxizi și oxigen la presiuni și temperaturi ridicate:
- Ozonidele conțin un ion de O3 cu un grad de oxidare de -1/3. Obținut prin acțiunea ozonului asupra hidroxizilor metalelor alcaline:
- Ion dioxigenul O2 + are o stare de oxidare de +1 / 2. Obținut prin reacție:
- Fluoruri de oxigen
- Oxid de difluorură. Gradul de oxidare OF2 +2 este obținut prin trecerea fluorului printr-o soluție alcalină:
-
- Oxid de monofluorură (dioxidifluorură), O2 F2. stare instabilă, oxidare +1. Obținut dintr-un amestec de fluor și oxigen într-o deversare strălucitoare la o temperatură de -196 ° C.
- Prin trecerea unei descărcări strălucitoare printr-un amestec de fluor și oxigen la o anumită presiune și temperatură se obțin amestecuri de fluoruri de oxigen mai mari O3 F2. O4 F2. O5 F2 și O6 F2.
- sprijină procesele de respirație, ardere, putrezire
- există în două modificări alotrope: O2 și O3 (Ozonul)
cerere
O utilizare industrială largă a oxigenului a început la mijlocul secolului al XX-lea, după inventarea turboexpanderilor - dispozitive pentru lichefierea și separarea aerului lichid.
În metalurgie
Metoda convertorului pentru producerea oțelului este asociată cu utilizarea oxigenului.
Sudarea și tăierea metalelor
Oxigenul în cilindri este folosit pe scară largă pentru tăierea cu flacără a gazelor și sudarea metalelor.
Ca oxidant pentru combustibilul de rachetă, se utilizează oxigen lichid. peroxid de hidrogen. acidul azotic și alți compuși bogați în oxigen. Amestecul de oxigen lichid și ozon lichid - unul dintre cei mai puternici agenți de oxidare propulsor (amestec specific de hidrogen impuls - ozon depășește impulsul specific pentru perechea -fluor oxigen -fluoride hidrogen și hidrogen).
În medicină
Oxigenul este utilizat pentru a îmbogăți amestecurile de gaze respiratorii (aeronetice) în cazul tulburărilor respiratorii. pentru tratamentul astmului. sub formă de cocteiluri cu oxigen, perne de oxigen etc.
În industria alimentară
În industria alimentară, oxigenul este înregistrat ca supliment alimentar E948 [1]. drept carburant și gaz de ambalare.
Rolul biologic al oxigenului
Ființele vii respira oxigenul aerului. Oxigenul este utilizat pe scară largă în medicină. În bolile cardiovasculare, pentru a îmbunătăți procesele metabolice, o spumă de oxigen ("cocktail de oxigen") este injectată în stomac. Administrarea subcutanată de oxigen este utilizată pentru ulcerele trofice, elefantiazele, gangrena și alte boli grave. Pentru dezinfecția și deodorizarea aerului și purificarea apei potabile, se utilizează îmbogățirea artificială cu ozon. Izotopul de oxigen radioactiv 15 O este folosit pentru a studia viteza fluxului sanguin, ventilația pulmonară.
Derivați de oxigen toxic
Unii derivați de oxigen (așa-numitele specii reactive de oxigen), cum ar fi oxigenul singlet. peroxid de hidrogen. superoxid. ozon și radical hidroxil. sunt produse extrem de toxice. Acestea se formează în timpul activării sau reducerii parțiale a oxigenului. Superoxidul (radicalul superoxid), peroxidul de hidrogen și radicalul hidroxil se pot forma în celulele și țesuturile corpului uman și animalelor și provoacă stres oxidativ.
Sunt izotopi radioactivi 11 O, 13 O 14 O (timp de înjumătățire de 74 de secunde), 15 O (T1 / 2 = 2,1 min), 19 O (T1 / 2 = 29.4 secunde), 20 O (date contradictorii privind timp de înjumătățire de la 10 min la 150 de ani).
Fapte interesante
- Moleculele de oxigen se deplasează la o temperatură a camerei cu o viteză medie superioară de 480 de metri pe secundă. [2]
Urmăriți ce este "oxigen (gaz)" în alte dicționare:
Oxigenul este un gaz, în apă este sub formă de molecule dizolvate. Prezenta sa este o condiție prealabilă pentru existența majorității organismelor care trăiesc în apă. În timpul verii, cantitatea de K. în apă este reînnoită continuu din atmosferă și prin izolarea acesteia ... ...
Oxigen - Acest termen are alte semnificații, vezi oxigenul (valorile). 8 Azot ← Oxigen → Fluorură ... Wikipedia
oxigen - a; m. Elementul chimic (O), gazul fără culoare și miros, care face parte din aerul necesar respirației și arderii și formării apei împreună cu hidrogenul. ◊ Blocați oxigenul la care l. Crearea condițiilor de viață insuportabile, a muncii. ◁ Oxigen, ... ... Dicționar enciclopedic
Element chimic OXYGEN - (Oxygenum latin); simbolul O; atomic numărul 8, masa atomică relativă 15,999. În condiții normale, oxigenul este gaz fără culoare și miros. În condiții normale, molecula de oxigen este diatomică (O2); într-un electric liniștit ... ... Dicționar metalurgic
OXIGEN - OXIGEN, cel mai ușor element al grupului VI din tabelul periodic al lui Mendeleev, simbol. Oh, numărul ordinal 8. K. gaz fără culoare, miros și gust. Nu are izotopi. Am. în. 16,000, Mol. în. 32.000. Sp. în. K. în ceea ce privește aerul 1,10535; la 0 ° și 760 ... Marea enciclopedie medicală
OXIGEN - (Ohugenum). Gaz incolor fără miros și gust. Puțin solubil în apă (aproximativ 1:43). Inhalările de oxigen sunt utilizate pe scară largă în diferite boli însoțite de hipoxie: cu boli respiratorii (pneumonie, edem pulmonar ...
OXIGEN (Oxigen), О, element chimic al grupului VI al sistemului periodic, numărul atomic 8, masa atomică 15,9994; gaz, lgsp. Oxigenul este cel mai obișnuit element, în atmosferă de 23,10% din masă de oxigen liber, în hidrosferă și ... ... Enciclopedia contemporană
OXIGEN - (Oxygenul latin) О, element chimic al grupului VI al sistemului periodic, atomic numărul 8, masa atomică 15,9994. În forma liberă apare sub forma a două modificări ale O2 (oxigen obișnuit) și O3 (ozon). O2 gaz fără culoare și miros, densitate de 1,42897 ... ... Dicționar encyclopedic mare
Oxigenul este elementul cel mai comun al crustei pământului. Sauder. este de 49,13 în greutate și de 91,8% în volum. În litosferă conține. 47% K în greutate, în hidrosferă 85,89% și în atmosferă 23,01%. Majoritatea covârșitoare a atomilor K (aproximativ 99,99%) are un conținut chimic ridicat ... ... Enciclopedie geologică
Oxigenul (oxigenul) este un gaz fără culoare și miros, reprezentând o cincime din aerul atmosferic total. Oxigenul este necesar pentru viață majorității organismelor vii, deoarece în timpul legăturii sale cu glucoza (sau uneori cu alte tipuri de surse de combustibil) în ... ... Termeni medicali
- Oxigen. Jesse Russell. Această carte va fi realizată în conformitate cu comanda dvs. privind tehnologia Print-on-Demand. Atenție vă rog! Cartea este o colecție de materiale de la Wikipedia și / sau alte surse online .... Citește mai mult Cumpărați pentru 9,95 dolari
- Oxigen în viața noastră. A. Yu Axelrod. Se știe că oxigenul este "gazul" vieții. Dar de ce celulele corpului au nevoie de oxigen? Cât de mult oxigen aveți nevoie de un minut? Într-o oră? Într-un an? Ce este "foametea de oxigen" și cum să lupte ... Citește mai mult Cumpărați pentru 140 de ruble
- Chimie incitantă. Editura pentru copii Elena. Faceți cunoștință cu: "Chimia fascinantă"! La sfârșitul acestei călătorii, unchiul Kuzya și Chevostik vor face mai multe experimente chimice în cea mai obișnuită bucătărie. Aceasta este o activitate foarte interesantă și, vreau ... Citește mai mult Cumpărați pentru 9,00 dolari audiobook
Articole similare
Trimiteți-le prietenilor: