Unele electroliți din soluții se descompun complet în ioni. Ele sunt numite puternice.
Alți electroliți se descompun numai parțial în ioni, adică majoritatea moleculelor lor rămân în soluție într-o formă nedissociată. Astfel de electroliți sunt numiți slabi.
Această proprietate a substanței nu este absolută și depinde nu numai de natura ei, ci și de natura solventului. Cu cât constanta dielectrică a solventului este mai mare, cu atât este mai slabă slăbirea ionizantă. Astfel, în soluții apoase (# 949; (H20) = 80). LiCl și NaCl se comportă ca electroliți puternici. Dar dacă sunt dizolvate în acid acetic (# 949; = 6) sau în acetonă (# 949; = 21), ele încep să prezinte proprietățile electroliților slabi.
Soluțiile apoase de electroliți puternici sunt săruri de baze solubile (formate, în mod tipic metale alcaline și alcalino-pământoase), unii acizi anorganici sau minerali (HCl, HBr, HI, H2 SO4. HNO3 și colab.).
În același timp, mulți acizi organici, unii acizi anorganici (HNO2. HF, H2 S, H2 SiO3. H3 PO4, etc.), insolubile în bază de H2O se comporta ca electroliti slabi.
Substanțele în care particulele sunt legate prin diferite tipuri de legături chimice, se descompun mai întâi în ioni pe legăturile ionice
și apoi - de-a lungul legăturilor covalente cele mai polare
Ruptura heterolitică a legăturilor covalente cu polar scăzut sau nepolar în procesele de disociere a unor astfel de substanțe, de regulă, nu are loc.
Din punct de vedere cantitativ, procesul de degradare a moleculelor de electroliți în ioni este estimat utilizând gradul de disociere electrolitică # 945; .
Gradul de disociere este raportul dintre numărul de molecule care s-au dezintegrat în ioni și numărul total al moleculelor din soluție (dezintegrat și nedizolvat):
NO = ND + NH (numărul de molecule nedisociate de electroliți în soluție)
Deoarece numărul particulelor unei substanțe (N) și cantitatea lor chimică (n) sunt legate de relația N = n # 8729; NA. atunci gradul de disociere poate fi calculat și într-un alt mod:
Pentru electroliți puternici # 945; este aproape de unitate. Practic, toate moleculele în soluție sunt în formă disociată, procesul de asociere este extrem de nesemnificativ.
În acest context, în ecuațiile de disociere a acestor substanțe, în loc de semnul reversibilității "", puneți semnul "®" (adică folosiți săgeata numai în direcția decăderii), de exemplu:
Pentru electroliții slabi, gradul de disociere este foarte mic (# 945;<<1). Так, для воды при 20 о С α ≈ 1 ∙ 10 –9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
Ca urmare a disocierii electrolitului, numărul particulelor sale în soluție crește. Acest lucru face posibilă determinarea experimentală a gradului de disociere de la măsurarea acelor proprietăți ale soluției, care depind numai de cantitatea de substanță dizolvată conținută în ea, dar nu de natura, dimensiunea sau masa lor. Aceste proprietăți includ punctul de fierbere și punctul de congelare al soluției, presiunea osmotică și altele.
Pentru soluții de electroliți slabi, valorile # 945; definite în moduri diferite, de regulă, coincid și este întotdeauna mult mai puțin decât unitatea, care este de acord cu teoria lui Arrhenius.
După cum arată studiile experimentale, gradul de disociere a electroliților slabi depinde de temperatura soluției și de concentrația acesteia.
Tabelul 8. Modificarea gradului de disociere a acidului acetic în funcție de concentrația molară a acestuia în soluție
Soia Ssn3, mol / dm 3
Pe măsură ce crește temperatura soluției, crește gradul de disociere; în timp ce o polarizare mai bună este asigurată și se facilitează ruptura ulterioară a legăturii polare covalente în moleculele de electroliți. Cu temperatură scăzută # 945; scade.
creșteri # 945; și cu o scădere a concentrației de soluții, adică când sunt diluate (tabelul 8), t. grosimea stratului ionizant care separă ionii devine mai mare, astfel încât interacțiunea electrostatică dintre ele, care conduce la asocierea ionilor în molecule, este observată mai rar.
Cu o diluție infinit de mare, gradul de disociere a electrolitului tinde la valoarea maximă, adică la unitate (Figura 30).
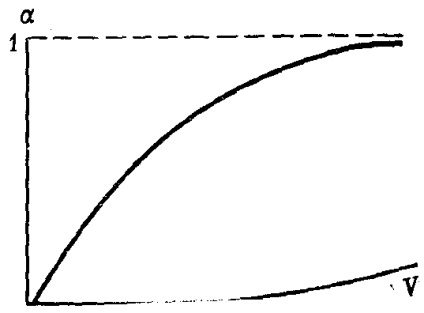
Fig. 30. Modificarea gradului de disociere electrolitică # 945; cu diluția V (schema)
Astfel, pentru electroliți slabi # 945; nu este o constantă. Prin urmare, capacitatea lor de a se descompune în ioni este mai convenabil de a compara în raport cu constanta de disociere, care este constanta de echilibru a reacției reversibile a descompunerii electrolitice a moleculelor de electroliți.
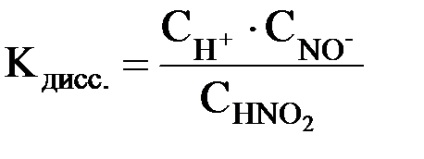
unde CH +. CH202-. CHNO2 - concentrații molari de echilibru ale ionilor H +. NO2 - și molecule HNO2 nedisociate.
Constanta de disociere a electroliților slabi nu depinde de concentrația lor în soluție, chiar și la o diluție considerabilă și rămâne constantă la o temperatură dată (Tabelul 9). Cu creșterea temperaturii soluției, constanta de disociere a electroliților slabi, în multe cazuri, variază într-o manieră complicată (Figura 31).
Tabelul 9. Dependența valorii Kdiss. acid acetic în soluție din concentrația molară a acestuia la T = 298 K
Soia Ssn3, mol / dm 3
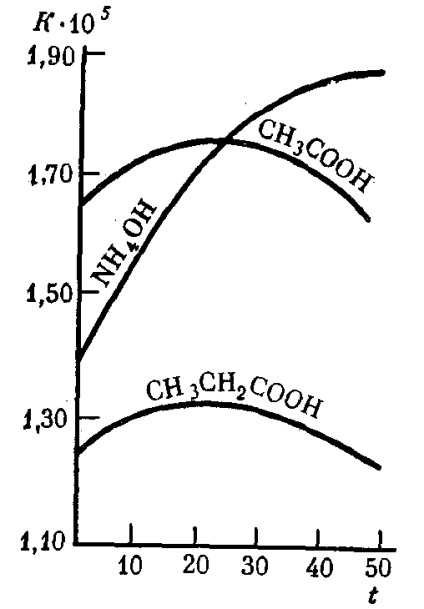
Fig. 31. Dependența constantei de disociere K a unor electroliți slabi în soluții apoase la temperatura t (° C)
Mai putin Kdiss .. cu atat este mai slab electrolitul dat. De exemplu, acidul acetic (K = 1,85 × 10-5) este aproape de 220 000 de ori mai puternic decât HCN cianhidric (K = 4,8 × 10-10) și de aproximativ 10 ori mai slab decât acidul formic (Kdis = 8 · 10-4).
Există electroliți slabi (acizi polibazici, baze multi-acizi), căderea lor în ioni are loc în trepte, adică în mai multe etape. În acest caz, fiecare etapă este caracterizată de constanta de disociere.
De exemplu, disocierea hidrogenului sulfurat se efectuează în cele două etape:
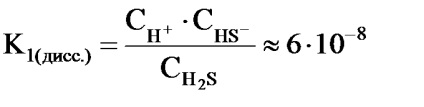
2) HS-H + + S2 -
Ecuația totală a reacției de disociere H2S este după cum urmează:
H2 S 2H + + S 2-
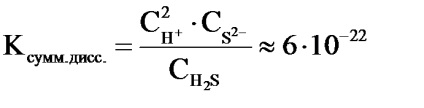
Mărimea constantei de disociere pentru ecuația totală și valorile constantelor de disociere ale etapelor individuale sunt legate între ele de relația:
Cu o disociere în etape, descompunerea unui electrolit slab în fiecare etapă ulterioară are loc într-o măsură mai mică decât cea anterioară, adică K1> K2> K3 și așa mai departe. Acest lucru se explică prin faptul că separarea ionilor nu are loc de la o moleculă neutră (ca în prima etapă), ci dintr-o particulă cu o încărcătură tot mai mare și, prin urmare, necesită o cheltuială mare de energie.
Adesea, pentru a evalua puterea unui electrolit slab, în locul constantei de disociere, logaritmul zecimal, luat cu semnul opus (pK)
În acest caz, cu cât valoarea pK este mai mare, cu atât electrolitul este mai slab.
Articole similare
-
Caracteristicile generale ale locului de practică universitară
-
Organizatorii caracteristicilor generale ale cifrei de afaceri - stadopedia
-
Floarea soarelui - caracteristică generală, descriere botanică, soiuri
Trimiteți-le prietenilor: