Pentru a studia comportarea unui gaz real, izotermele considera van der Waals - curbele de la date T temperaturile determinate de ecuația van der Waals pentru 1 mol de gaz (Figura 9.2.). Aceste curbe sunt considerate pentru patru temperaturi diferite. La temperaturi ridicate, izotermia unui gaz real diferă de izotermia unui gaz ideal doar printr-o anumită distorsionare a formei sale, rămânând o curbă în scădere monotonică. La o anumită temperatură pe izotermă există un punct de inflexiune K. Această izotermă se numește critică, iar temperatura corespunzătoare se numește temperatura critică. iar punctul K este un punct critic. O stare cu parametri critici se numește stare critică.
La temperaturi, izotermele au o secțiune inductivă. În izotermele reale, nu există o astfel de curl, în loc de aceasta, ele au o porțiune orizontală rectilinie (în figura 9.2 ele sunt indicate printr-o linie punctată). Dacă prin punctele de capăt ale secțiunilor orizontale ale izotermelor de familie să dețină linie, veți obține o curbă clopot care mărginește regiunea statelor din două faze a materiei. Această curbă și P graficul critic izotermă divide, V sub Izoterma în trei regiuni: o curbă clopot este regiunea de condiții în două faze (lichid și saturat de vapori F + P), la stânga acesteia există o zonă de stare lichidă (F), iar dreapta - pereche regiune ( P). Aburul diferă de celelalte stări gazoase prin faptul că este supus unui proces de lichefiere sub presiune izotermică. Gazul la o temperatură mai mare decât cel critic nu poate fi transformat într-un lichid la orice presiune.
2. Stări metastabile (meta-greacă, după, în acest caz, după o stare stabilă, state instabile).
Considerăm că o parte a izotermei din Fig. 9.3. Stările din secțiunea 2-3 nu sunt realizate, deoarece pe el. și anume creșterea volumului de gaz ar fi însoțită de nici o scădere, iar presiunea crește - proprietăți destul de nenatural. În secțiunile 1-2 și 3-4. acest lucru este normal, dar se pare că aceste state nu sunt complet stabile. Este suficient să se constate A particulele de praf care intră aburul la materialul dezintegrat în două faze și a fost transferat într-un B. stare (Reamintim că faza se numește omogenă, identică în proprietățile sistemului. De exemplu, apa într-un vas închis, iar amestecul de aer și vapori de apă. Vaporii, Echilibrul cu lichidul său se numește saturat.
Presiunea la care se observă echilibrul se numește presiunea saturată de vapori). Statele similare cu statul A (instabile) sunt numite stări metastabile. Statul 1-2, unde presiunea este mai mică la o temperatură dată, se numește lichid supraîncălzit. și 3-4
() Este o vapa suprasaturata. Să analizăm starea vaporilor suprasaturați. Pentru a forma picături de lichid, moleculele trebuie să se apropie reciproc de o distanță de ordinul distanței dintre moleculele din lichid. Aceasta necesită prezența unor centre de condensare (particule de praf, particule încărcate, picături de lichid). Camera nor (om de știință britanic, 1927 Nobel Prize.) Aerul saturat cu vapori de apă se extinde rapid și, respectiv, se răcește. Vaporii se află într-o stare de suprasaturație. Dacă o particulă încărcată intră în cameră, vaporii se condensează pe picături mici, formând o urmă vizibilă ("pistă") când se mișcă.
Luați în considerare un lichid supraîncălzit. Dacă lichidul este curățat complet de incluziuni solide, atunci prin încălzirea sau coborârea presiunii la acesta, acesta poate fi transferat într-o stare de supraîncălzire. Trecerea unei particule încărcate duce la formarea de-a lungul urmei unei particule de centre germinale de fierbere. Bulele sunt fotografiate.
Să analizăm în detaliu starea din Com. K (figura 9.2). În acest moment, diferența dintre densitățile lichidului și vaporii saturați dispar complet. În același timp, orice diferență dintre lichid și vapori dispare. De asemenea, nu există nici o limită între lichid și vapori. Primul și al doilea derivat de presiune în raport cu volumul sunt zero.
3. Energia internă a unui gaz real. În plus față de energia cinetică include energia potențială a interacțiunii moleculelor de gaze. Lucrarea efectuată la extinderea gazului împotriva forțelor de atracție reciprocă a moleculelor unul față de celălalt este egală cu creșterea energiei de interacțiune. Van der Waals corectarea presiunii. Atunci lucrați. prin urmare, energia potențială
Când gazul real tinde spre ideal și apoi:
Anterior, pentru energia cinetică a mișcării termice haotice a moleculelor, sa obținut :.
Energia internă a unui gaz real, ținând cont atât de energiile cinetice, cât și de cele potențiale:
Adică energia internă a moliului gazului Van der Waals este o funcție a stării gazului.
4. Efectul Joule-Thomson
Joule - temperatura gazului Thomson se schimbă ca urmare a strangulării adiabatic - debitul de gaz lent sub o diferență de presiune constantă peste obstacol ștrangulare (de exemplu, o membrană poroasă Dr. - înece în figura 9.4.). Termenul "adiabatic" înseamnă fără schimbul de căldură cu mediul. Adiabaticitatea poate fi realizată, de exemplu, prin intermediul unui înveliș termoizolant în jurul canalului. la
Deplasarea pistonului (P) produce o scădere constantă a presiunii (). Distingem a) efectul pozitiv pentru T. atunci când temperatura gazului real este coborâtă și b) efectul negativ. când (pentru un gaz ideal T = const). Interesul practic este un efect pozitiv. Se observă un efect pozitiv în regiunea presiunilor, unde predomină forțele de atracție
între molecule. Când se extinde, moleculele de gaz lucrează împotriva forțelor de atracție, iar temperatura scade. În acest caz, energia cinetică a mișcării termice a gazului este folosită pentru a lucra împotriva forțelor de atracție moleculară.
Schimbarea temperaturii poate fi semnificativă. De exemplu, aerul, care se extinde la temperatura camerei de la o presiune de 200 atm la o presiune de 1 atm, este răcit cu aproximativ 40 ° C.
Procesul este utilizat în tehnica de lichefiere a gazelor. Efectul Joule-Thomson se bazează pe activitatea așa-numitei mașini Linde.
Gazele lichefiate și obținerea temperaturilor scăzute
Gazul poate fi transformat într-o stare lichidă dacă temperatura sa este sub critică și sub punctul de fierbere la o anumită presiune.
Machine Linde (om de știință german) (Figura 9.5)
Aerul atmosferic este comprimat de compresor (K) la o presiune de 220 atm. Aerul comprimat trece prin conductă și este răcit cu apă curentă la 10 15. Apoi, aerul intră pe canalul intern
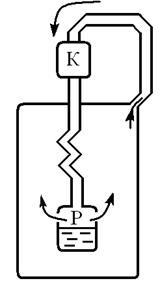
bobină de unde în rezervor (P), unde presiunea este de 20 atm. Aerul este răcit de 50. (Extinderea are loc în regiunea efectului Joule-Thomson pozitiv). Aerul răcit prin canalul extern al bobinei este condus spre compresor, răcind următoarele porțiuni de aer, care curg prin canalul intern etc. La o temperatură de 180 ° C și o presiune de 20 atm. începe condensarea aerului. Aerul lichid curge în rezervor.
Turbodetandru Kapitza (om de știință rus, câștigător al Premiului Nobel, 1894 - 1984). Gazul, comprimat de compresor (K) la o presiune de 6-7 atm, intră în turbină (T), se extinde la o presiune de 1,3 atm. funcționează, răcește, apoi răcește gazul care intră în compresor, circulă etc. și, în final, se condensează. Această metodă poate produce azot lichid, oxigen, hidrogen, heliu. (Rețineți că punctul de fierbere al oxigenului lichid este de 90 K, azot 78 K, hidrogen 20 K, heliu 4.2 K). Gazele lichide sunt utilizate în metalurgie, medicină, aviație.
Articole similare
-
Izotermele lui van der Waals și compararea lor cu izotermele experimentale
-
Накрутка funcționează într-adevăr verificat - joc - un junk - secrete
Trimiteți-le prietenilor: