Metoda de respingere a perechilor de electroni
Metoda aeronavei este baza pentru determinarea unghiurilor dintre legături și distorsiunile lor sub influența perechilor de electroni care nu se leagă. În același timp, se presupune că există o repulsie a perechilor de electroni ale carcasei de valență (OEVVO).
Baza fizică a metodei OEPVO propusă de Gillespie și Nyholm, sunt determinate de principiul lui Pauli: având în vedere faptul că orbital atomic ocupă o anumită regiune a spațiului, se poate argumenta că, în acest domeniu nu poate fi decât o pereche de electroni, celălalt va fi împins în afara zonei.
Astfel, poziția capului metoda OEPVO constă în faptul că perechea de electroni din stratul de valență al unui atom (molecula) se resping reciproc și sunt aranjate în jurul unui atom în acest mod (sub aceste unghiuri) la această repulsie este redusă la minim.
Denumim molecula (sau fragmentul ei) ABn. unde A - atomul central B - atom lateral (ligand), n - numărul de atomi în perechi în jurul A. Electronic în jurul atomului A poate fi obligatorie (atom B este atașat) și nonbonding sau neparticipanți (notate cu X, și E, respectiv). Apoi perechile atom de electroni intr-o molecula ABN A (considerând pereche nonbonding) pot fi desemnate ca Em Ahn .Dacă număr etomobschee de perechi de electroni este egală cu n + m. Formula ia în considerare numai acele perechi de electroni care sunt s - poziția atomului de A, adică densitatea lor electronice destinate pentru comunicarea cu atomii pe axa B; toate perechile de e-e sunt de asemenea în poziția s. Metoda OEPVO considerând hibridizarea accepta ca toate perechile de electroni ocupă aproximativ același spațiu. Pentru simplitate, ele sunt considerate a fi sfere de aceeași rază. Evident, dacă dimensiunile tuturor perechilor electronice din jurul atomului A sunt aceleași, ele formează figurile corecte.
Metoda OEPVO determină schimbarea în formele de molecule și unghiuri de distorsiune între obligațiuni în comparație cu ideale datorită perechii de electroni unshared și legături multiple, și dispunerea reciprocă a atomilor inegale și perechi de electroni. Pentru a utiliza această metodă, este necesar să se stabilească în primul rând:
1) numărul total de perechi de electroni ai atomului A;
2) conform acestui număr - forma figurii corecte formate de nori de electroni;
3) în plus, este necesar să se stabilească câte dintre ele sunt obligatorii, neobligatorii și multiple. Cel mai convenabil mod de a face acest lucru este prin utilizarea circuitului VS al acestei molecule;
4) După aceasta, puteți determina geometria moleculei.
Să enumerăm principalele prevederi ale METEPM.
1. Perechile electronice non-obligatorii resping mai puternice decât perechile de legare, astfel încât distorsionează forma moleculei. Dacă, de exemplu, compoziția perechilor electronice avem molecule cum ar fi AX3 (NO3-) și AX2E (NO2-), atunci forma lor în conformitate cu regula 1 va fi următoarea
(Figura 3.15):
Fig. 4.15 Forma moleculelor în hibridizarea sp2
2. Deoarece perechile electronice nelegate repetă mai repede, atunci în prezența mai multor perechi de electroni care nu se leagă, ele se află la o distanță maximă una față de cealaltă. De exemplu, pentru moleculele de tip AB4 cu perechi de electroni de tip AX4 E2 (XeF4)
(. Figura 3.16, a) va fi formă plană benefică (sp 3 hibridare d 2), precum și pentru moleculele de tip AB2 cu perechi de electroni AX2 E3 (de exemplu, HeF2) - (. Figura 3.16, b) liniare.
În cel de-al doilea caz, unghiurile dintre perechi în planul ecuatorial sunt mai mari decât între el și axa (120 și 90 0), astfel încât repulsia reciprocă a E-E în plan va fi mai mică.
3. Cu cât este mai mare electronegativitatea atomilor terminali (B), cu atât sunt mai puternici, ei sunt respinși de perechile de electroni care nu sunt tăiați, adică unghiurile BAB sunt mai mici. De exemplu, moleculele cu perechi de electroni de tip AX3 E (NH3 și NF3) au unghiuri: Ð HNH = 107 ° și Ð FNF = 102 °, care corespunde cu EO (H) = 2,1 și EO (F) = 4.
E E 5s 5p 5d Xe * x x x x E
Fig. 4.16, a. Schema BC și formula structurală a moleculei XeF4
E E E 5s 5p 5d Xe * x x F 2p ½ E 2 Xe ¾ E 1 E 2s F F F Fig. 4.16, b. Schema BC și formula structurală a moleculei XeF2
4. Mai multe conexiuni resping mai puternice decât cele obișnuite. De exemplu, molecula HeO3 F2 are trei atomi de oxigen în (unghiul OHeO = 120 °), deoarece acestea au legături duble și molecula UO2 F5 -3 (tip AB7 (tip AB5 bipyramid trigonala, perechi de electroni AH5 + 3π.) - pentagonal perechi de electroni bipyramid AH7 + 2π) are un aranjament liniar de atomi de oxigen, deoarece unghiurile FUF = 72 °, adică mai puțin de 90 °.
5. Distorsiunea unghiurilor dintre legăturile sub influența unei perechi de electroni neparticipată crește cu creșterea numărului de AO liber pe cochilia de valență a atomului, iar dimensiunile sale devin mai mari. De exemplu, în același tip de molecule NH3. PH3. AsH3, unghiul din această serie scade odată cu creșterea numărului de AO de valență (Tabelul 4.3). Același lucru se poate spune despre moleculele H2O, H2S, H2Se.
Influența numărului de AO de valență asupra unghiului de valență
Fig. 4.17. Structura moleculară
Molecule SOCl2. Luăm un atom de sulf într-o stare excitat pentru a forma trei s-legături cu atomi de clor (doi) și oxigen (unul). Un alt electron neprotejat duce la formarea unei legături p cu atomul de oxigen (Figura 3.18). Numărul de perechi de electroni în poziția s, luând în considerare 3s-AO nelegat la atomul de sulf - patru: AX3 E + p-bond (sp3-hibridizare). AX3E dă configurația unui tetraedru distorsionat de o pereche de electroni nelegate E. Lipsa unui atom în locul lui E ne dă în locul unui tetraedru o piramidă trigonală
(Tabelul 3.4). Toate unghiurile vor fi mai mici decât cele tetraedrice (Ð109,28 °) și, în plus, se poate prezice că unghiul ClSCI va fi mai mic decât ClSO în conformitate cu regula 4.
Astfel, metoda DEEP poate prezice geometria moleculelor. Totuși, ea nu o face corect în toate cazurile. Această teorie este cea mai potrivită pentru compușii covalenți ai elementelor s și p.
Numărul de perechi electronice localizate ale centralelor
atom și configurația spațială a moleculelor ABn
s - perechi de electroni de atomi A
Compoziția și forma perechii de molecule și electroni
Polaritatea legăturii covalente. Proprietăți electrice. Atomii și moleculele conțin particule încărcate electric - electroni (# 275;) și nuclei cu încărcare + Z. Deoarece electronii se deplasează rapid într-o regiune relativ mare în apropierea nucleului, pentru a determina proprietățile electrice ale atomilor și moleculelor, este necesar să se introducă conceptul de "centru de greutate" sau poli de încărcare electrică negativă și pozitivă. Este evident că în atomul ei coincid și atomul este nepolar. Această situație apare și în unele molecule: diatomic (E2) și, de asemenea, poliatomic foarte simetric (CH4, BF3, SF6, etc.).
3s 3d 3d S * E x x x p
Fig. 4.18. Schema BC și formula structurală
Dacă "centrul de greutate" al încărcăturilor negative și pozitive nu coincide, atunci molecula este polară și formează un dipol, caracterizat de un moment dipol, a cărui valoare absolută
unde # 948; - încărcarea polului, l - distanța dintre poli, săgeata indică faptul că dipolul este o valoare vectorială.
Valoarea m este măsurată în sistemul SI în Clm (pendant pe metru). Valorile tipice pot fi estimate de la încărcarea unui electron (»10 - 19 Cl) și lungimea distanței interatomice (» 10 - 10 m), adică ele se ridică la 10 - 29 Cl-m. Pentru confort, se utilizează o unitate specială pentru măsurarea momentului dipolului: Debye (D):
Pentru a caracteriza dipolul, pe lângă magnitudinea și direcția sa, încărcarea efectivă Eficiența și lungimea dipolului l. Aceste valori într-o anumită măsură diferă de gradul de oxidare și, respectiv, de lungimea legăturii.
Momentele dipol ale moleculelor care conțin legături polare sunt definite ca suma momentelor dipol ale legăturilor. În acest caz se face adiția vectorilor de dipoli pe legături (în literatura chimică, direcția de la "+" la "-" este considerată direcția pozitivă a dipolului). Suma celor două dipoli se obține ca diagonala paralelipipedului construit pe ele. De exemplu, pentru molecula unghiulară AB2:
Dacă dipolii sunt mai mult de 2, atunci ele sunt stivuite în perechi. Evident, pentru moleculele liniare AB2. planul triunghiular - AB3. tetraedru și pătrat - АВ4. trigonal-bipyramidal - AB5. octaedric - AB6. momentul dipolului este zero.
Tabelul 4.5 prezintă momentele dipol ale unor substanțe și în tabelul 4.6 - încărcăturile efective (în unități de încărcare electronică) asupra atomilor din anumiți compuși.
Acțiunile eficiente care caracterizează asimetria norii de electroni sunt condiționate, deoarece norul de electroni este delocalizat și nu poate fi "împărțit" între nuclee; astfel încât valorile taxelor să depindă de metoda de determinare.
Momentele dipol ale unor molecule
Ca măsură a polarității legăturii sau moleculei, gradul de ionicitate (i) sau covalența (K) este adesea folosit.
Deci, dacă în molecula de HCl qCl = 0.2qe. și wCl = -1, atunci i = 0,2, adică gradul de ionicitate este de 20%, iar gradul de covalență este de 80%.
Mărimea ionicității legăturii A-B poate fi, de asemenea, estimată din diferența de electronegativitate a atomilor (DEE) (Tabelul 4.7,
Fig. 4.19).
Figura 4.19 aproximează relația stabilită de Pauling între gradul de ionicitate al legăturii și diferența în electronegativitatea elementelor. Rezultă din figură că numai fluorurile alcaline și alcalino-pământoase pot fi considerate aproape de ioni.
Deoarece pentru fluorurile de metale alcaline aproximativ 3, atunci
i »90%, care este aproape de o legătură pur ionică.
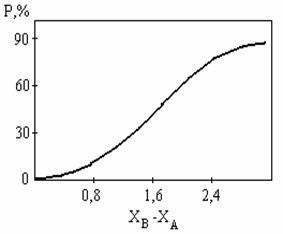
Fig. 4.19. Dependența gradului de ionicitate al unei obligațiuni asupra diferenței
electronegativitatea elementelor (de Pauling)
Dependența gradului de ionizare asupra diferenței
Această dependență este neliniară, iar cifrele în sine sunt foarte apropiate, ca toate dependențele asociate cu electronegativitatea elementului.
Deoarece cantitățile # 967; și sunt caracteristici importante ale atomilor și legăturilor chimice în compuși, este de asemenea util să avem o formulă matematică pentru relația dintre ele:
Această formulă nu pretinde a fi exactă, la fel ca valorile ionicității și electronegativității însăși, dar este practic utilă când compară ionicitatea legăturilor chimice.
Utilizând căutarea puteți găsi informațiile de pe site.
Pagina generată în 0.04 secunde.
Articole similare
Trimiteți-le prietenilor: