Când electronii umple orbitele atomice, se observă următoarele trei reguli:
1. Principiul stabilității (principiul energiei minime). Orbitalele sunt umplute începând cu cea mai mică energie și apoi în ordinea cresterii. În acest caz, energia atomului este minimă, iar stabilitatea - maximul.
secvența de energie poate fi descrisă cu ușurință prin regula sumă a primelor două numere cuantice n + l. Această regulă se numește regula Klechkovsky (1951):
La umplerea atomului cochilii orbitale sunt de preferat (mai energic favorabile) și astfel completate înainte de acele state pentru care suma principalului număr cuantic n, și o latură (orbital) cuantic număr l, adică n + 1, are o valoare mai mică.
De exemplu, orbitalul 4s. pentru care n + l = 4 + 0 = 4, este umplut mai devreme decât orbitalul 3d. unde suma n + l = 3 + 2 = 5.
Atunci când sumele sunt mai mici în energie, există o orbită cu o valoare mai mică a numărului principal de consolă. Astfel, orbitalul 3d are o energie mai mică decât 4p.
Ordinea obișnuită de umplere a orbitalilor atomici:
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f =5d <6p <7s <5f=6d …
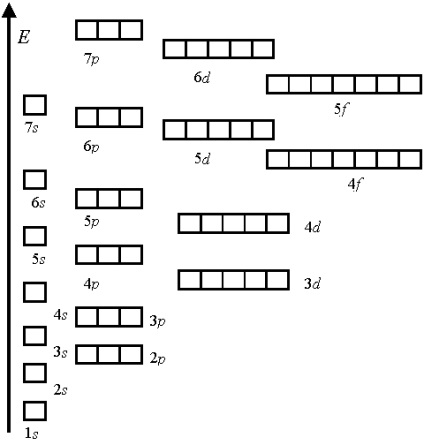
Numărul orbitalilor la fiecare nivel electronic.
2. Principiul Pauli. nu pot exista doi electroni într-un cristal, pentru care toate cele patru numere cuantice ar fi aceleași.
Nu pot exista mai mult de doi electroni pe orbital și numai dacă au rotiri îndreptate opus. Astfel de electroni se numesc perechi.
3. Regula lui Hund (1925). Un atom în starea solului trebuie să aibă un număr maxim posibil de electroni nepartiți într-o anumită subsol.
Umplerea orbitalelor de azot energetic: a - schema corectă, b - circuitul greșit.
Articole similare
Trimiteți-le prietenilor: