Printre substanțele biologic active conținute în organism, ionii metalici ocupă un loc special. Deci, biocatiile sunt cele mai sensibile "puncte chimice" ale corpului. Aceste elemente biogene ale vieții se găsesc în organism, în principal sub formă de soluții apoase ale sărurilor lor și compuși complexi (de coordonare).
Compușii complexi sunt compuși ai căror situri de zăbrele conțin particule complexe (ioni complexi) constând dintr-un atom central sau ion și molecule sau ioni neutri din jur. Ionii complexi nu sunt distruși când ajung în soluție sau se topesc.
Structura compușilor complexi a fost explicată în teoria coordonării lui A. Werner (1893). Potrivit teoriei de coordonare a lui Werner, compușii complexi sunt caracterizați de un aranjament spațial special al particulelor care alcătuiesc moleculele lor. De exemplu: K + | CN - CN - | K +
Din formula de coordonare de mai sus rezultă că unul dintre ioni ocupă o poziție centrală. Un astfel de atom sau ion este numit agent de complexare. In majoritatea agenților de complexare sunt încărcate pozitiv ioni metalici, majoritatea metalelor subgrupe secundare (Elemente f d- și), mult mai puțin - atomi de metal neutru (Fe, Ni) și atomii încărcați negativ nemetalelor (N -3 O -2 S ..). Agenții de complexare tipici sunt metale cum ar fi Fe, Cu, Ag, Au, Hg, Co, Cr, Mn, Cd, Ni, Pt etc. Lângă agentul de complexare moleculele polar sau ionii unui semn diferit sunt localizate într-o anumită ordine, uneori ambele sunt numite liganzi (addende), ceea ce înseamnă "conectat". Cele mai importante liganzi sunt:
a) molecule neutre cu caracter dipol: H2O, NH3. CO, NO, C2H4.
b) ioni: H -. O -2. OH -. Cl -. J -. Br -. CN -. HCO3 -. precum și bioligandi sub formă de macromolecule de aminoacizi și derivații lor, peptide, proteine, enzime, hormoni, acizi nucleici și fragmentele lor.
Agentul de complexare și liganzii formează o sferă interioară (notată cu paranteze pătrate), iar ionii care nu intră în sfera interioară formează o sferă exterioară. Sfera interioară este adesea închisă în paranteze pătrate. Încărcarea unui ion complex este egală cu suma algebrică a sarcinilor agentului de complexare și a liganzilor. Numărul de liganzi localizați în imediata vecinătate a ionului central se numește numărul de coordonare al ionului (c.ch.). Adesea există numere de coordonare 2, 4, 6. De obicei, numărul de coordonare este de două ori încărcarea agentului de complexare, cu excepția ionului Fe2 +. pentru care k.ch. este egal cu 6, pentru Pt 4+ - 6.
În cazul în care liganzii sunt legați printr-o singură legătură și complexare ocupă un sit de coordonare în sfera interioară a complexului, astfel de liganzi sunt denumiți monodentantnymi (OH -. Cl -. J -. Br. - CN), două -bidentantnymi (CO3 2- 2- C2 O4). - ocupă 2 puncte de coordonare. Unii liganzi sunt atașați la ionul central și un număr mare de legături de coordonare. Deci, printre compușii organici complexi există aceia care pot acționa ca trei, tetra - și mai mult - se numesc polidantanți. Liganzii organici polidenzanți, fiind închisi prin două sau mai multe legături de coordonare, pot forma complecși ciclici.
Moleculele compușilor complexi au o structură geometrică complet definită. De exemplu, doi liganzi sunt adesea situate în apropierea ionul metalic astfel încât ionul central și ligandul 2 sunt coliniare. Trei liganzi sunt situate în colțurile unui triunghi, patru - pe colțurile unui pătrat sau un tetraedru (tetraedru), șase - în colțurile octaedru (octaedru), opt - în colțurile cubului. În cazul în care liganzii nu sunt identice, atunci forma geometrică poate să nu fie complet corecte (distorsionate), dar, cu toate acestea, liganzii sunt fixate la anumite puncte ale spațiului din jurul ionului central.
Compușii complexi sunt clasificați prin încărcarea unui ion complex și prin tipul de liganzi. Conform taxa ionului complex sunt complecși cationici (complexul cu o sarcină pozitivă), anionice (complex încărcat negativ), neutre (un complex de zero taxa).
Prin tip complecși ligand sunt: acidocomplexes - liganzi sunt resturile de acid (Cl - J - Br - CN - HCO3 - CO3 2- C2 O4 2 -......); Hidroxiplexele (OH -); acvacomplexe (H2O); aminocomplexe (NH3); amestecat, când complexul include mai multe tipuri de liganzi.
Prin urmare, pentru a scrie corect formula pentru un compus complex, este necesar să se cunoască: sarcina (starea de oxidare) a agentului de complexare; încărcarea liganzilor; numărul de coordonare a agentului de chelare; ioni ai sferei exterioare.
Atunci când se scrie formulele complexe de ioni, este mai întâi indicat simbolul agentului de complexare, apoi liganzii neutri sunt enumerați în ordinea de H2O, NH3. După liganzi neutri, urmează liganzi anionici. Liganzii anionici sunt enumerați în ordinea: H -. Despre -2. HE -. anionii simpli, anionii complexi ai acizilor anorganici, anionii de acizi organici.
Formulele compușilor complexi sunt citite strict de la dreapta la stânga, observând în formula ordinea de aranjare a liganzilor. În numele compușilor complexi, se anunță mai întâi anionul în cazul nominativ și apoi cationul în cazul genitiv.
I. Dacă compusul conține un cation complex. liganzii sunt numiți mai întâi în ordinea localizării în complex, urmată de numele agentului de complexare (numele rus al elementului). În paranteze, cifrele romane arată starea de oxidare a agentului de complexare. Moleculele neutre care acționează ca liganzi au numele lor obișnuit, cu excepția amoniacului - aminei, apei - aqua, CO - carbonilului, NO - nitrosilului. Liganzii încărcați negativ sunt denumiți "o". De exemplu, N - - hidrido, O -2 - oxo, OH - - hidroxo, F - - fluor, clor - - clor, S -2 - tio, CN - - cian, SO4 -2 - sulfato, CH 3 COO - - acetato , CNS - - tiocianat, C2O4 - 2 - oxalat. Dacă există mai multe liganzi, atunci se numește ionul sferic exterior, apoi liganzii sunt numere grecești: - 2-di, 3-trei, etc.
De exemplu: numele cationilor complexe
[C0H20 (NH3) 5] C13-pentaamină clorură de quancobalt (III)
[Pt (NH3) 5CI] Cl3-clorură de cloropentaammină platină (IV)
[PtH20 (NH3) 2OH] NO3-nitrat de hidroxodiamondină quinaplatinum (II)
II. Dacă compusul conține un anion complex. apoi liganzii sunt numiți mai întâi în ordinea indicată mai sus. Mai mult, agentul de complexare este numit folosind rădăcina denumirii sale latine cu adăugarea silabei "la", după care cifrele romane indică în paranteze gradul de oxidare a agentului de complexare. Ultimul nume este cationul sferei exterioare în cazul genitiv. De exemplu:
K [Ag (CN) 2] -dicianoargenat (I) de potasiu
K2 [CuCl4] - tetraclorocupatul de potasiu (II)
K3 [Fe (CN) 6] - hexacianoferrat (III) de potasiu
Numele complexelor neutre este alcătuit din numele liganzilor și numele rus al agentului de complexare în cazul nominativ. Valența agentului de complexare nu este indicată. De exemplu: [CO (NH3) 3Cl3] - triclorotriamină cobalt.
[Pt (NH3) 2CI4] - tetraclorodiamină platină.
Sferele interioare și exterioare din moleculele compușilor complexi sunt legați printr-o legătură ionică. Și ligandul de complexare este legat printr-o legătură covalentă a mecanismului donor-acceptor: liganzi acționează ca un donor a unei perechi de electroni, iar agentul de complexare - rolul acceptor. pe orbita liberă a căruia este localizată perechea de electroni a ligandului.
Disocierea compușilor complexi se desfășoară în două etape. disociere primară a compușilor complecși este de electroliți puternici de tip ionizare si curge uniform: [Ag (NH3) 2] Cl → [Ag (NH3) 2] + + Cl -
Liganzii cu un agent de complexare sunt legați de o legătură mai puternică, iar disocierea ionului complex avansează într-o măsură mai mică. Acest tip de disociere se numește secundar.
Măsurarea stabilității unui ion complex este constanta instabilității sale și este notată de Kn.
Cu cât este mai mică stabilitatea instabilității, cu atât este mai stabilă complexul.
Compușii complexi joacă un rol imens în procesele de activitate vitală a plantelor și a animalelor. În organismul animalelor și plantelor compușii complexi îndeplinesc o varietate de funcții: acumularea și transferul diferitelor substanțe și energie; formarea și împărțirea legăturilor chimice; participarea la procesele de respirație, fotosinteză, oxidare biologică și cataliză enzimatică. Astfel de substanțe biologic importante, cum ar fi hemoglobina, clorofila, cianobolamina, sunt compuși chelați intracomplexi. În ele, patru puncte de coordonare sunt ocupate de o particulă numită porfin, iar agentul de complexare în hemoglobină este - Fe +2. și în clorofil - Mg 2. în vitamina B12 - Co +3.
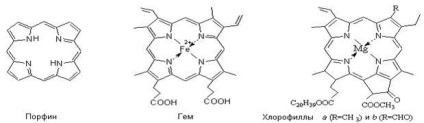
Porfirinelor complex de fier are o structură plană, în care ionul de fier este conectat coordinare cu 4 inele pirolului 4, 5 sunt în proteine globinei aderare comunicare, dar în a șasea sferă de coordonare liber. Acest loc este ocupat de o moleculă de oxigen transportată de hemoglobină în procesul de respirație.
Recent a constatat că complexele de platină și paladiu au un efect inhibitor asupra dezvoltării tumorilor maligne și pot fi folosite cu succes în scopuri terapeutice, de chelare (chelat) compuși sunt utilizați în sărurile dizolvarea în pietre la rinichi și reducând duritatea apei datorită prezenței ionilor de calciu și magneziu. Este cunoscută o activitate bactericidă ridicată a anumitor compuși complexi de argint. Trilon B (EDTA) este capabil să formeze complexe cu multe metale, inclusiv Ca +2. Acest lucru face posibilă utilizarea acestuia pentru bolile însoțite de depunerea excesivă de săruri de calciu în organism.
Articole similare
Trimiteți-le prietenilor: