Gradul de disociere electrolitică Deoarece disocierea electrolitică este un proces reversibil, moleculele există de asemenea în soluții de electroliți împreună cu ionii lor. Cu alte cuvinte, conform teoriei lui S. Arrhenius, diferiți electroliți se disociază în ioni în grade diferite. Completitudinea degradării (rezistența electrolitului) este caracterizată de o valoare cantitativă - gradul de disociere. Gradul de disociere (# 945; - litera greacă alfa) este raportul dintre numărul de molecule care s-au degradat în ioni (n) la numărul total de molecule dizolvate (N):
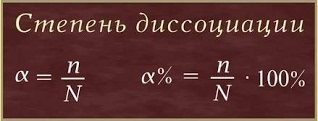
Valoarea gradului de disociere (# 945;)
1. săruri solubile; 2. Acizi puternici (HCI, HBr, HI, HN03, HCI04.H2S04 (dec.)); 3. Baze puternice - alcaline.
1. Aproape toți acizii organici (CH3COOH, C2H5COOH etc.); 2. Unii acizi anorganici (H2CO3, H2S, etc.); 3. Aproape toate sărurile, bazele și hidroxidul de amoniu (Ca3 (PO4) 2; Cu (OH) 2; Al (OH) 3; NH4OH) insolubile în apă; 4. Apă.
1) Odată ajuns într-un forum chimic, un școală a scris: "Și în cele din urmă nu înțeleg (așa sa scris) de ce NaCl în soluție se descompune în Na + și Cl-. și nu pe Na - și Cl + ». Cum ați explica esența a ceea ce se întâmplă în soluția omului sărac? Care este secțiunea importantă a chimiei din vremea noastră "a ratat" pe nefericitul nostru elev?
EXEMPLE DE SOLUȚIONARE A PROBLEMELOR:
Problema 1. Determinați gradul de disociere a electrolitului, dacă la 20 ° C din fiecare 150 de molecule se descompune în ioni 90. Este electrolitul puternic sau slab?
Problema 2. Determinați câte molecule de electroliți au fost disociate în soluție, dacă gradul de disociere a electrolitului este de 0,1 și 3,01 • 10 20 molecule au fost introduse în soluție.
Sarcini de auto-control
1. Se calculează gradul de disociere a acidului boric H3 BO3. dacă se știe că în soluția din fiecare 500 de molecule se dizolvă doar 40 de ioni. Este electrolitul puternic, mediu sau slab în putere?
2. Calculați câte molecule de electrolit disociază de la fiecare 120 de molecule în soluție, dacă gradul de disociere este de 95%.
Articole similare
Trimiteți-le prietenilor: