Electroliza soluției de NaCl este cea mai simplă și cea mai economică metodă de producere simultană a trei produse chimice importante - clor, hidrogen și hidroxid de sodiu, utilizând materii prime ieftine și accesibile naturale. Aceasta este cea mai mare producție electrochimică la scară. Reacția totală dintr-un electrolizer poate fi exprimată prin ecuație
Clorul este utilizat pe scară largă ca materie primă pentru producerea de solvenți organoclorici și materiale plastice, cauciuc sintetic, fibre chimice și pesticide. În metalurgie, clorul este utilizat pentru clorinarea prăjitului de minereuri, în industria textilă și industria celulozei și celulozei - pentru curățarea și albirea pulpei, pastă de hârtie și țesături. Cantități mari de clor sunt utilizate pentru curățarea și sterilizarea apei uzate și a apei potabile.
Hidroxidul de sodiu este utilizat în fabricarea multor produse chimice, în special în sinteza organică industriale, în industria celulozei și hârtiei, la fabricarea fibrelor artificiale metalice (producție de aluminiu), în industria petrochimică și altele.
Importanța hidrogenului drept combustibil al viitorului și reactiv chimic a fost menționată mai devreme.
Electroliza soluției de NaCl se realizează prin două metode, diferite în ceea ce privește natura proceselor de electrozi și în ceea ce privește instrumentația:
1. electroliza cu un catod solid și o diafragmă de filtrare;
2. electroliza fără diafragmă cu catod lichid de mercur.
Produsele gazoase - clorul și hidrogenul, în orice mod, se caracterizează printr-o puritate ridicată. În electroliza cu catod de mercur și al treilea produs, soluția de hidroxid de sodiu are o concentrație ridicată de NaOH și este chimic pură. Datorită purității produselor rezultate, simplu și compact designul hardware, precum și soluția-o singură etapă a procesului de electroliza NaCl este singura metodă de producere a clorului din lume și calea principală pentru producerea de hidroxid de sodiu.
Electroliza soluției de NaCl cu catod solid și diafragmă de filtrare
Când acest proces este implementat, următoarele procese se desfășoară la catod în conformitate cu valorile potențialelor electrodului:
Materialele pentru catod sunt oțel, pe care se eliberează hidrogen cu o supratensiune relativ mică (0,3 V). În condiții de electroliză reale (soluție concentrată de clorură de sodiu, conținând hidroxid de sodiu, temperatura de 90 ° C) efectiv hidrogen potențial evoluție este de aproximativ - Potențialul 0,845 V. Reducerea .3-.4 V poate fi realizată prin utilizarea catozilor de grafit poros pentru întărire și hidrofobizare impregnat politetrafluoretilenă și activat de săruri de cupru sau de argint.
Acumulatorii de ioni de hidroxid în spațiul catodic formează molecule neutre de hidroxid de sodiu
La anod clorul este eliberat:
Materialul anodului este ruteniu-sistem de oxid (Compoziția de oxizi de ruteniu și de titan sprijinit pe o bază de titan), care posedă puterea și inerției chimice în raport cu oxigenul este un produs secundar generat la anod:
În plus, în volumul electrolitului din spațiul anodic, ca urmare a hidrolizei clorului, apar reacții chimice:
Anionul hipoclorit format ca urmare a acestei reacții succesive este supus oxidării anodice
Reacțiile adverse reduc randamentul actual al produselor principale și măresc coeficienții de consum energetic. Prin urmare, condițiile de electroliză și concentrația electroliților trebuie să asigure curgerea minimă a reacțiilor adverse și randamentul maxim de curent al produselor țintă. În acest scop, electroliza este realizată în celule continue cu diafragme de filtrare verticale în mișcare în contracurent a ionilor electroliți și OH. Diagrama celulară este prezentată în Fig. 1.
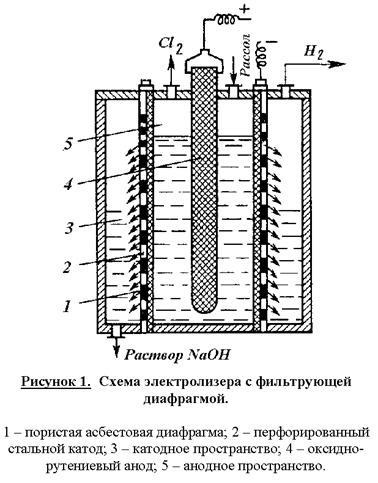
Corpul băii din această structură este împărțit într-un spațiu catodic și anod printr-o diafragmă poroasă din azbest, modificată cu substanțe polimerice. Diafragma se potrivește strâns cu catodul din sticlă perforată. În celulele electrolitice moderne, catodii au o formă ramificată în formă de pieptene pentru dezvoltarea suprafeței. Anodul anodic-ruteniu este localizat în spațiul anodic. Salina purificată este alimentată în spațiul anodic și, datorită presiunii hidrostatice, este filtrată prin diafragmă și catod în spațiul catodic. Hidrogenul și o soluție de hidroxid de sodiu sunt extrase în mod continuu din spațiul catodic și clorul din compartimentul anodic. Gazul de clor rezultat conține 95-96% Cl2. Gazul de clor este răcit la 20 ° C (apa este condensată) și uscată în continuare prin spălare cu acid sulfuric concentrat. Produsul catodic, soluție de hidroxid de sodiu, conține 120-140 g / l NaOH și 170-180 g / l NaCI nedegradat. Soluția este evaporată, în timp ce NaCl trece într-o fază solidă, deoarece solubilitatea sa scade drastic odată cu creșterea concentrației de NaOH. După evaporarea și topirea lichidelor, hidroxidul de sodiu conținând 92 până la 95% NaOH și 2 până la 4% NaCI este anhidru.
Datorită electrolitului în contracurent și a ionilor OH. acestea din urmă practic nu intră în spațiul anodic, iar reacțiile secundare (5), (7) - (9), pentru care sunt responsabile, sunt reduse la minimum.
Electroliza soluției de clorură de sodiu cu catod de mercur
La catod de mercur, reacțiile de electrod (1) și (2) sunt ridicate de supratensiune - potențial de descărcare de 1,7 - de 1.8 V. sodiu alocate la un catod de mercur, cu un efect de depolarizare mare și capacitatea de evacuare de Na + mercur este mult mai mic și este egală cu standardul 1,23 V. fenomenul catodului depolarizare mercurului este prevăzut astfel încât evacuarea ionilor de sodiu are loc cu formarea de compuși chimici - amalgam de sodiu
care este îndepărtată continuu de pe suprafața anodului, dizolvând în exces mercurul. Pe anodul perforat de grafit (sau oxid-ruteniu), clor
Amalgamul de sodiu care conține 0,1 - 0,3% Na se îndepărtează din celulă și se descompune cu apă încălzită într-un reactor de descompunere separat. În descompunere există o reacție electrochimică corespunzătoare procesului în celula galvanică scurt-circuitată NaHgn [NaOH] C în care amalgamul servește drept catod
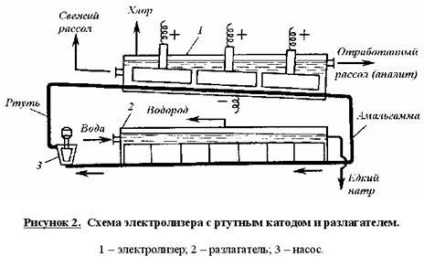
Circuitul unei celule cu un catod de mercur este arătat în figura 2.
Soluție adâncă purificată concentrată de clorură de sodiu a fost alimentată în celula de electroliză alungită înclinată, după care partea de jos prin gravitație, saramură contracurent, se mută de mercur, servind ca un catod. Mercurului este oxid orizontal ruteniu (sau grafit perforat) anod, cufundat în saramură. Lichidul anod care cuprinde NaCI nereacționat, derivată din celula împreună cu clor-gaz, care este separată în coloanele de separare și de purjare (nu este prezentată în diagramă). Clorul este alimentat la uscare și purificare după obeskhlorenny saramură și mercur impurități din roca de sare saturată și sa întors în celula electrolitică. amalgam de sodiu curge din celula într-un reactor înclinat-descompunător, care se deplasează în contracurent cu apă distilată, furnizat într-o cantitate pentru a obține o soluție de NaOH 45% th. In partea de jos a dezamalgamare are placa de grafit pieptene formând amalgam de celule electrochimice comptată Nahg n [NaOH] C. evacuate hidroxid de sodiu separat în separatoarele de hidrogen și transmise consumatorilor. Mercurul care emană de la decompozitor este pompat la electrolizor printr-o pompă de mercur.
Deoarece nu se formează alcaline în stadiul de electroliză, în procesul cu catodul de mercur, reacțiile secundare (5), (7) - (9) sunt excluse și procesul este caracterizat printr-un curent ridicat și o ieșire de energie.
Cu toate acestea, metoda de electroliză cu catod de mercur necesită curățare în special aprofundată sursei de saramura circulant, întrucât impuritatea de magneziu, fierul, calciul și alte metale, pentru a reduce supratensiunea hidrogenului cu catod de mercur, ceea ce poate duce la perturbarea procesului de catod și de explozii.
electroliză cu catod de mercur dă foarte concentrate sunt necesare soluții chimic pure de hidroxid de sodiu pentru o varietate de consumatori, în special în producția de fibre sintetice, în sinteza și prepararea materialelor schimbătoare de ioni, și altele. Cu toate acestea, utilizarea mercurului este dăunătoare pentru sănătatea umană. Pentru obținerea de soluții chimic pure de NaOH a început să se aplice o soluție de electroliză NaCl cu o membrană schimbătoare de ioni (schimb de cationi) care separă spațiile anozilor și catozilor. Această metodă este mai complicată în proiectarea și funcționarea echipamentelor hardware, dar este mult mai sigură decât mercurul. Metoda de electroliză prin membrană, precum și diafragma, poate fi considerată un proces tehnologic cu pierderi reduse.
Articole similare
Trimiteți-le prietenilor: