Plumbul este un element chimic situat în a șasea perioadă din grupul IVB din tabelul periodic. Universitatea Mendeleev.
Numărul de ordine este 82. Structura atomului este prezentată în Fig. 1. Metal din familia d.
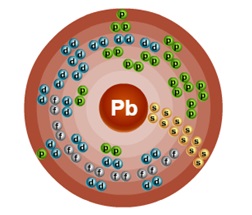
Fig. 1. Diagrama structurii atomului de plumb.
În condiții normale, plumbul este o substanță într-o stare solidă agregată de culoare alb-albăstrui. În secțiune, suprafața plumbului strălucește. În aer, este acoperit cu un film de oxizi și din cauza acestui dimes. El este foarte moale și tăiat cu un cuțit. Are conductivitate termică scăzută. Densitatea este de 11,34 g / cm3. Punctul de topire este 327,46 ° C, punctul de fierbere este de 1749 ° C.
Masa molară a plumbului este de 207,2 g / mol. Această valoare indică raportul masic al substanței (m) th numărul de moli de o anumită substanță (n), notat cu M, și poate fi calculat prin formula:
Cu alte cuvinte, masa molară a substanței - este greutatea 1 mol de substanță, exprimată în g / mol sau kkmol.
Plumbul nu poate exista sub formă de gaz, numai sub forma unui solid, astfel încât să se găsească valoarea masei sale moleculare, nu puteți utiliza volumul molar sau să efectuați calcule utilizând formula Mendeleev-Clapeyron.
Exemple de rezolvare a problemelor
Scrieți ecuațiile pentru reacțiile de hidroliză ale azotatului de plumb (II). Care va fi reacția mediului în soluția acestei sări?
Să notăm ecuația de disociere pentru nitratul de plumb (II):
Această sare este formată dintr-o bază slabă (hidroxid de plumb (Pb (OH) 2) și acid tare (acid nitric HNO3), prin urmare, hidroliza trece prin cation.
Pb 2+ + HOH ↔ PbOH + + H +;
PbOH + HOH ↔ Pb (OH) 2 + H +;
Reacția mediului este acidă, după cum reiese din prezența ionilor de hidrogen.
La o soluție de azotat de plumb (II) 80g greutate (fracțiunea de masă de sare, 6,6%) a crescut iodură de sodiu soluție 60 g (NaI fracțiunea de masă de 5%). Se calculează masa de plumb de iodură (II) precipitată.
Să scriem ecuația de reacție a interacțiunii nitratului de plumb (II) cu iodura de sodiu:
Să găsim masele de substanțe dizolvate ale nitratului de plumb (II) și iodurii de sodiu:
ω = msolute / msolu × 100%;
msolute = ω / 100% × msolution;
msolute (NaI) = ω (NaI) / 100% x soluție (NaI);
(NaI) = 5/100% × 60 = 3 g.
Am găsit numărul de moli de substanțe nereacționată (masa molară de azotat de plumb (II) este de 331 g / mol, iodură de sodiu - 150 g / mol) și de a determina care dintre ele este în exces:
n (NaI) = msolute (NaI) / M (NaI);
n (NaI) = 3/150 = 0,02 mol.
Iodura de sodiu este în exces, prin urmare, toate calculele suplimentare se efectuează pe azotat de plumb (II). n (Pb (N03) 2). n (PbI2) = 1: 1, adică n (Pb (N03) 2) = n (PbI2) = 0,016 mol. Apoi masa iodurii de plumb (II) va fi egală (masa molară - 461 g / mol):
m (PbI2) = 0,016 x 461 = 7,376 g.
Articole similare
Trimiteți-le prietenilor: