Zonke (1879 ᴦ.), Cermak, Schoenflies, Fedorov (1891 ᴦ.) Și alții au arătat geometrically că întregul e ?? forme cristaline pot fi prezente ca rezultat partiționat ?? Eniya puncte (cele mai mici particule vesche-guvernamentale), în spațiul de lege simetrie ; Configurațiile rezultate au numit laturi de cristal.
Distribuind puncte în spațiu în funcție de elementele de simetrie, au obținut 230 de combinații, 230 de laturi cristaline, care corespund tuturor formelor cristaline care apar în natură.
Studiul ulterior al cristalelor cu ajutorul fasciculelor cu raze X de către omul de știință german Laue (1912) a confirmat acele ipoteze și concluzii care au fost făcute indirect. Au fost obținute dovezi directe privind existența atomilor, a ionilor și a modalităților de localizare a acestora în spațiu.

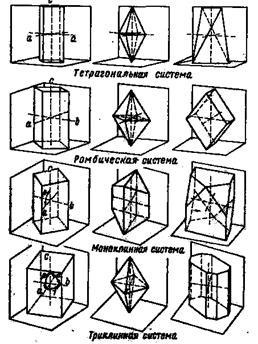
Figura 6. Reprezentarea schematică a fețelor de bază și de cristal
Grilele cristaline, după cum sa dovedit, sunt împărțite în următoarele grupe: atomice, ionice, moleculare și metalice.
Gratare atomice. Fiecare loc nodal din rețeaua atomică este ocupat de un atom neutru. Un exemplu este rețeaua cristalină de argon prezentată în figura 7.
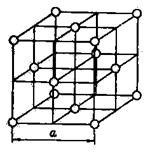
Fig. 7. Rețeaua de argon cristalină
Ion laturi. Fiecare loc nodal din rețeaua ionică este ocupat de un ion. Exemple de grătare ionice sunt prezentate în Figurile 8 și 9. Fig. 8a prezintă rețeaua cristalină Na + Cl-. în Fig. 8.6 este rețeaua CsJ; în Fig. 9 prezintă rețeaua cristalină a CaF2.
Grinzile de cristal de Na + Cl sunt tipice pentru electroliții binari, constă din două centre de zăbrele centrate pe fețe, împinse unul în altul cu jumătate din lungimea marginii cubului. O latură este cationul de Na +. Un alt astfel de anion este C1.
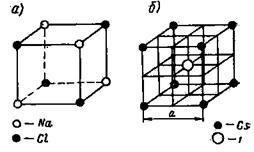
Fig. 8. Rețea cristalină de NaCl și CsJ
Câmpul cristal Cs + J este o combinație de două laturi simple cubice: rețeaua de ioni Cs + și rețeaua ionică J -. inserate una în cealaltă astfel încât în centrul cubului să fie ionul de iod și în colțurile ionilor Cs +. Această latură este centrat în spațiu astfel încât să existe un anion în centrul cubului și cationi în colțuri.
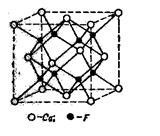
Fig. 9. Rețeaua cristalină a CaF2
Rețeaua cristalină a Ca2 + F2 este tipică pentru mulți electroliți ternari. Aici ionii Ca 2+ formează o latură cristalină centrat pe fețe, în timp ce ionii F se formează în mijlocul a opt cuburi mici, pe care trebuie așezat un cub mare.
În laturile cristaline ionice, siturile individuale pot lua ioni complexe și complexe. Exemple: rețeaua de nitrat de sodiu Na + NO3 - (figura 9a) și rețeaua de hexacloroplatinat de potasiu K + [PtCl6] 2- (figura 10, b). Aici locurile separate sunt ocupate de ioni: Na +. K +. NO3 -. [PtCl6] 2-.
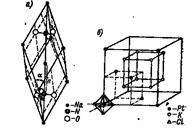
Fig. 10. Rețea cristalină de azotat de sodiu și hexacloroplatinat de potasiu.
În rețeaua cristalină a azotatului de sodiu, fiecare ion de NO3 ocupă un loc, iar în centrul tetraedrului este atomul de azot N + 5. și în colțuri - atomi de oxigen O; Atomii sunt aproape unul de celălalt și formează un grup puternic, strâns strâns.
Același grup este un ion complex complex [PtCl6] 2-. Spațial, acesta este construit după cum urmează: în centrul octaedrului este ionul Pt 4+. iar în colțuri - ionii C1 -.
Ionii [PtCl6] 2- ocupă unghiurile laturii cubice centrate pe fețe. Ionii K + sunt cubi.
Grilele moleculare. În laturile moleculare, locurile separate sunt ocupate de molecule. Un exemplu de site moleculare conectate ?? eny, care sunt considerate în chimia anorganică, pot servi ca rețeaua cristalină a aluminei (Fig. 11a) și dioxid de carbon CO2 (Fig. 11.6). În rețeaua cristalină a oxidului de aluminiu Al2 Oz colțurile romboidală, cu o lungime de nervuri # 945; o = 5,12A ocupă atomi strâns grupați, formând o moleculă neutră.
În cristalinul, centrat pe fețele lattice ale dioxidului de carbon, moleculele de CO 2 neutre ocupă locuri separate. grupuri foarte apropiate de trei atomi de C și ZO, grupate după cum se arată în Fig.
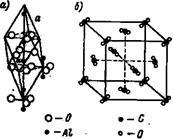
Fig. 11. Rețea cristalină de oxid de aluminiu și dioxid de carbon CO2
Grilaje metalice. Grilajele metalice sunt caracterizate de proprietăți speciale care le diferențiază de alte tipuri de laturi de cristal. La nodurile laturilor metalice nu sunt atomi, ci ioni pozitivi. Externe atomi de metal de electroni migrează liber în rețeaua cristalină, re-mersul pe jos de la un ion la altul, adică. E. ComportaŃi cum ar fi Molek Lamas gaz, deci totalitatea electronilor în rețeaua metalică numită gaz de electroni.
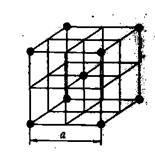
Fig. 12. Rețea cristalină de sodiu metalic
Tᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, o latură metalică poate fi considerată ca o latură ionică situată în "atmosfera" unui gaz de electroni de la electronii externi. Aceasta este, de exemplu, rețeaua de sodiu metalic (Figura 12). Proprietățile caracteristice ale metalelor - conductivitatea electrică și conductivitatea termică, în special, depind de mișcarea electronilor din interiorul rețelei. Sub influența unui câmp electric extern, electronii de valență, al căror număr este mic în metale (1, 2 sau 3), se mișcă în direcția câmpului, creând conductivitate electrică.
Pentru a produce echipamente în diferite zone ale industriei moderne, sunt folosite cele mai diverse materiale, atât naturale, cât și cele artificiale. În același timp, baza tehnologiei moderne - mașini și mecanisme - este realizată în principal din materiale metalice - metale, aliaje metalice, unele cu altele și unele nemetale, în primul rând cu carbon. Acest lucru se datorează faptului că, din toate tipurile de materiale, materialele metalice au cele mai valoroase proprietăți mecanice. În același timp, materialele metalice sunt foarte numeroase și diverse în proprietățile lor.

În stare lichidă, majoritatea metalelor se dizolvă una în alta și formează un aliaj lichid omogen. Când se cristalizează dintr-o stare topită, diferite metale se comportă diferit. Cazurile principale sunt următoarele:
1. În stare solidă, metalele topite nu se dizolvă și nu interacționează chimic unul cu celălalt. În aceste condiții, aliajul este un amestec mecanic și constă din cristalite ale uneia și celorlalte componente detectate distinct pe microsecție (figura 13).
2. Metalele topite interacționează una cu alta, formând un compus chimic.
3. În timpul cristalizării din topitură, se păstrează solubilitatea metalelor între ele. Se formează cristale omogene. În acest caz, faza solidă se numește o soluție solidă (Figura 14). În același timp, pentru unele metale, solubilitatea lor mutuală în stare solidă este nelimitată, în timp ce altele sunt solubile între ele numai până la anumite concentrații.
Citiți de asemenea
Metalele din modul obișnuit de producție au o structură cristalină. Vcrrystallahatoms sunt localizate într-o manieră strict ordonată, astfel încât, dacă trasează linii imaginare de-a lungul celor trei axe de coordonate prin centrele lor, ele formează o linie spațială (cristalină). [citeste mai mult].
Legătura metalică se datorează unei scăderi a energiei cristalului, datorită colectivizării totale a electronilor carcaselor exterioare și parțiale. Legătura de hidrogen se datorează hibridării electronilor atomului de hidrogen cu atomi electronegativi. [citeste mai mult].
Zonke (1879), Cermak, Schoenflies Fedorov (1891) și alții au arătat că toate geometrically formele cristaline pot fi prezente ca urmare a distribuției punctelor (cele mai mici particule vesche-guvernamentale), în spațiul de pe legile de simetrie; au numit configurațiile rezultate. [citeste mai mult].
Metalele din metoda obișnuită de producție au o structură cristalină. În cristale, atomii sunt aranjați într-un mod strict ordonat, astfel încât, dacă trasează linii imaginare de-a lungul celor trei axe de coordonate prin centrele lor, ele formează o linie spațială. [citeste mai mult].
Articole similare
Trimiteți-le prietenilor: