Figura 24. Oxidarea fierului conform legii parabolice: 1 - 975 0 С, 9 - 650 0 С.
Valoarea constantei din ecuatia de mai sus poate fi calculata pentru = 0, M = M0. Apoi ecuația ia forma:
Sub forma fracțiunii reacționate = 1 - M / M0, ecuația parabolică poate fi transformată:
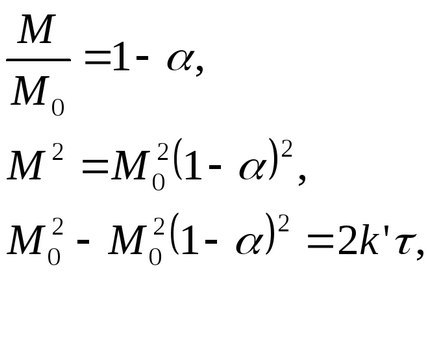
Dacă solidul are o suprafață sferică, soluția de mai sus nu este aplicabilă, deoarece F este în mod continuu scăzut în timpul reacției. Au fost propuse mai multe soluții ale acestei probleme: unele sunt aproximative, unele sunt exacte.
Soluția aproximativă a lui Yander (1927).
Rata de creștere a produsului de reacție este invers proporțională cu grosimea sa:
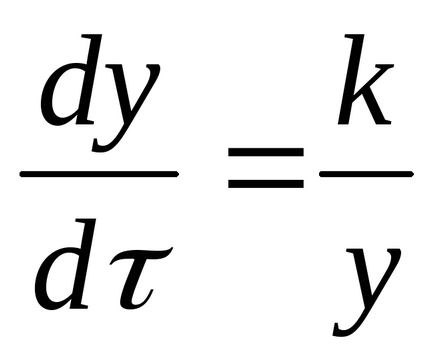
, unde y este grosimea stratului de produs și k este constantitatea proporționalității.
Dacă r0 este raza inițială a particulei, atunci fracțiunea reacționată va fi
;
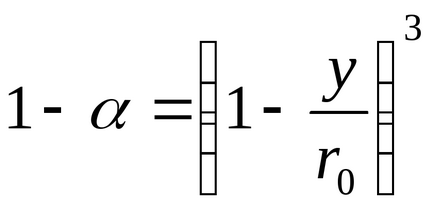
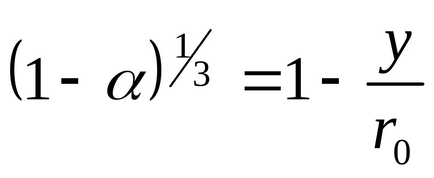
Înlocuind valoarea y în ecuația (109), obținem
Graficul 1- (1-) 1/3 2 cu privire la timp va da o linie dreaptă.

Trimiteți-le prietenilor: