Informații generale privind structura moleculei de apă
Apa este substanța cea mai comună în unitate. Molecula de apă are forma H2O.
Apa este un compus termodinamic stabil. Energia Gibbs standard a formării de apă în stare lichidă, la o temperatură de 298 L plăgii - 237 57kDzh / mol, vapori de apă - 228.94 kJ / mol. În acest sens, constanta de disociere a vaporilor de apă la hidrogen și oxigen este foarte mică (8,88 × 10-41).
Starea agregată a apei este determinată de temperatură și presiune (Figura 1). AO curba de echilibru corespunde sistemului de gheață perechi, DO - echilibru de congelare în sistemul de vapori de apă curba OC - echilibru în vaporii de apă, iar OB curba - echilibru al sistemului de apă rece ca gheața. În punctul O, toate curbele se intersectează. Acest punct este numit un punct triplu și corespunde unui echilibru în sistemul de gheață-vapori.
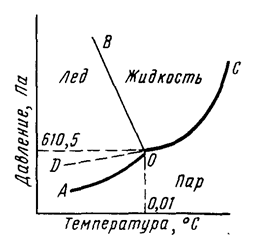
Fig. 1. Diagrama stării apei.
Structura electronică a moleculei de apă
Molecula structurală de apă are forma H2O. Să notăm configurațiile electronice ale atomilor de oxigen și hidrogen în starea de bază și apoi să le tragem formulele electron-grafice:
8 Despre 1s 2s 2p 2p 4
Atunci când se formează o moleculă de apă, norii electronilor a doi electroni 2p nepartiți ai atomului de oxigen se suprapun cu nori de electroni 1s de doi atomi de hidrogen; Schema acestei suprapuneri este prezentată în Fig. 2. Deoarece norul de electroni p-atomilor de oxigen sunt orientate în direcții reciproc perpendiculare, molecula de apă are o structură unghiulară, în care se poate aștepta ca unghiul dintre legăturile O-H va fi 90 o.
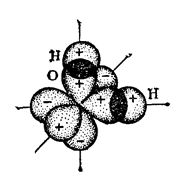
Fig. 2. Diagrama structurii moleculei de apă.
Cu toate acestea, în practică, unghiul de valență între atomii de oxigen și hidrogen diferă de 90 °. este de 104,5 o.
Exemple de rezolvare a problemelor
Scrieți ecuațiile de reacție dintre apă și următoarele substanțe: a) calciu; b) monoxid de carbon (IV); c) fierul când este încălzit); d) oxid de sulf (VI); e) oxid de calciu.
Când se dizolvă calciu în apă, se formează o soluție de culoare albă (hidroxid de calciu) și bule de gaz (hidrogen):
Când monoxidul de carbon (IV) este dizolvat în apă, se formează acid carbonic. Aceasta este o reacție reversibilă:
Când un fier roșu-fierbinte interacționează cu vaporii de apă, are loc o reacție chimică, a cărei ecuație este:
Când oxidul de sulf (VI) trece prin apă, acidul sulfuric se formează:
Când oxidul de calciu se dizolvă în apă, se formează hidroxid de calciu. Reacția este însoțită de eliberarea căldurii (exotermă):
Ce masă de hidrogen va fi eliberată dacă se adaugă 1 g de calciu în apă?
Să scriem ecuația reacției de dizolvare a calciului în apă:
Calculați cantitatea de calciu care a reacționat (masa molară - 40 g / mol):
n (Ca) = 1/40 = 0,025 mol.
Conform ecuației de reacție n (Ca). n (H2) = 1,1, adică n (Ca) = n (H2) = 0,025 mol. Apoi, masa hidrogenului eliberat va fi egală (masa molară - 2 g / mol):
m (H2) = 0,025 x 2 = 0,05 g.
Articole similare
-
Broderia literelor din alfabetul rusesc al schemei și exemple de fonturi
-
Village kvashnino Tula - harta si harta locului, director de telefoane, istorie, fotografie, vreme
Trimiteți-le prietenilor: