Atunci când metalul nu este scufundat în apă, ci într-o soluție de sare a acestui metal, echilibrul în conformitate cu principiul Le Chatelier se deplasează spre stânga și cu atât mai mare este concentrația de ioni metalici în soluție. Metalele active, ale căror ioni au capacitatea bună de a trece în soluție, vor fi încărcate negativ, deși într-o măsură mai mică decât în apa pură.
Echilibrul poate fi mutat spre dreapta, dacă unul sau altul îndepărtează electronii din metal. Aceasta va duce la dizolvarea plăcii metalice. În schimb, dacă electronii sunt introduși de pe o placă metalică pe placa metalică, atunci din soluție vor precipita ioni.
Când un metal este scufundat într-o soluție la interfață, se formează un strat dublu electric. Diferența potențială care apare între metal și faza sa lichidă înconjurătoare se numește potențialul electrodului. Acest potențial este o caracteristică a capacității de oxidare-reducere a unui metal sub forma unei faze solide.
La atom de metal izolat (stare de vapori monoatomica, care are loc atunci când temperaturile ridicate și un grad înalt de vid) proprietăți redox caracterizate printr-o altă valoare, numită potențialul de ionizare. Potențialul de ionizare este energia necesară pentru a detașa un electron de un atom izolat.
Valoarea absolută a potențialului electrodului nu poate fi măsurată direct. În același timp, nu este dificil să se măsoare diferența dintre potențialele electrodului care apar într-un sistem format din două perechi de metale. Astfel de perechi se numesc semi-elemente. Am convenit să determinăm potențialul de electrozi al metalelor în ceea ce privește așa numitul electrod hidrogen standard, al cărui potențial este arbitrar considerat zero. electrod standard de hidrogen este format dintr-o placă de platină special preparat imersat într-o soluție de acid cu o concentrație de ioni de hidrogen de 1 mol / l și se spală cu un jet de gaz de hidrogen la o presiune de 105 Pa, la o temperatură de 25 ° C
Un număr de potențiale standard de electrod. Dacă o placă metalică imersată într-o soluție de sare a acesteia cu o concentrație de ioni metalici egală cu 1 mol / l este conectată la un electrod standard de hidrogen, atunci se obține o celulă galvanică. Forța electromotoare a acestui element (EMF), măsurată la 25 ° C, caracterizează potențialul electrod standard al unui metal, de obicei marcat ca E °.
Potențialele standard ale electrozilor care acționează ca agenți reducători în ceea ce privește hidrogenul au semnul "-", iar semnul "+" are potențialul standard al electrozilor care sunt oxidanți.
Fier, aranjate în ordinea crescătoare a potențialului lor de electrod standard, formează așa-numita serie electrochimică a metalelor tensiuni: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni , Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Un număr de solicitări caracterizează proprietățile chimice ale metalelor:
1. Cu cât este mai negativ potențialul electrodului unui metal, cu atât capacitatea lui de reducere este mai mare.
2. Fiecare metal este capabil să deplaseze (restabilească) de la soluțiile de sare acele metale care stau în seria electrochimică de solicitări de metale după el.
3. Toate metalele care au un potențial negativ de electrod standard, adică cele din seria electrochimică de tensiuni metalice din stânga hidrogenului, sunt capabile să-l înlocuiască din soluții acide.
Ca și în cazul determinării valorii E ° a metalelor, valorile E ° ale metalelor nemetalice sunt măsurate la o temperatură de 25 ° C și la o concentrație a tuturor particulelor atomice și moleculare care participă la un echilibru de 1 mol / litru.
Valoarea algebrică a potențialului standard de oxidare-reducere caracterizează activitatea oxidativă a formei oxidate corespunzătoare. Prin urmare, compararea valorilor
standardele potențiale de reducere a oxidării permit să se răspundă la întrebarea: are loc această reacție de reducere a oxidării?
Un criteriu cantitativ pentru evaluarea posibilității de apariție a unei reacții specifice de reducere a oxidării este valoarea pozitivă a diferenței dintre potențialele de oxidare și reducere standard ale reacțiilor de jumătate ale oxidării și reducerii.
Electrodul HYDROGEN în electrochimie este de obicei o placă platinată imersată într-o soluție acidă cu o anumită concentrație de ioni de H + și spălată cu hidrogen gazos. La o presiune a hidrogenului de 0,1 MPa și activitatea termodinamică a ionilor săi egali cu unitatea, potențialul electrodului hidrogen este presupus în mod condiționat ca fiind zero. Un astfel de electrod hidrogen este numit standard, servind ca un electrod de referință, de unde se numără potențialul altor electrozi.
32 Termodinamica cursului proceselor electrodului. Reacții spontane de reducere a oxidării. Relația dintre EMF a unei celule galvanice și energia Gibbs. Relația dintre EMF și constanta de echilibru
Orice reacții chimice sunt asociate cu mișcarea electronilor, astfel încât acestea pot fi folosite pentru a genera un curent electric. În același timp, sursa de energie electrică este energia eliberată în timpul reacției chimice. O astfel de transformare a energiei unei reacții chimice într-una electrică este posibilă numai prin intermediul unui dispozitiv special numit celulă galvanică. Vă permite să direcționați fluxul de electroni prin conductorii metalici.
Simpla ardere a hidrogenului este însoțită de o eliberare mare de căldură. Dacă se efectuează la un volum constant, de exemplu, într-o bomba calorimetrică, atunci DU = -284,5 kJ / mol. Dacă aceeași reacție este efectuată într-o celulă electrochimică într-o celulă galvanică, o parte din această pierdere de energie internă poate fi utilizată pentru a obține un curent electric. Circuitul unei astfel de celule galvanice este prezentat în figura IX.1. Doi electrozi de platină sunt imersați într-o soluție apoasă (de exemplu, NaOH). Electrodul din stânga este spălat cu bule de hidrogen, iar electrodul drept cu oxigen. Hidrogenul din partea stângă a acestei celule este dizolvat în platină și ionizat. Datorită afinității mari pentru moleculele de apă, un număr de protoni trec în stratul de soluție imediat adiacent la electrod. În acest caz se formează ioni de hidroxoniu H3O + - sunt indicați de plusurile din partea dreaptă a Fig. IX. 1, în timp ce electronii (minus) rămân pe suprafața electrodului platinei. Datorită atracției electrostatice dintre electroni și ionii de hidroxoniu, acestea din urmă rămân în apropierea electrodului și nu scapă în volumul soluției. Din acest motiv, pe interfața cu soluția metalică apare un strat dublu electric, similar cu cele două plăci de condensatoare. Pe suprafața electrodului drept, apare formarea ionilor de hidroxil:
3 / 2O2g + H3O2 + 2e = 2OH-
în urma căruia doi electroni sunt îndepărtați din metal. Suprafața metalului, prin urmare, se încarcă pozitiv și se formează un strat electric dublu pe acesta, dar pe semnul opus. Dacă conectați electrozii din stânga și din dreapta cu un conductor metalic, atunci un curent electric va curge prin el. Săgeata din Fig. IX.1 indică direcția fluxului de electroni. Diferența potențialelor electrice pe electrozii unei celule galvanice deschise se numește forța electromotoare (emf).
Evident, fluxul de electroni care apar în element poate fi folosit pentru a produce lucruri, de exemplu, pentru a roti un motor electric. Debitul curent duce la o scădere a încărcărilor straturilor electrice duble. Prin urmare, ionii H3O + și OH- pot fi îndepărtați din electrozii și formează molecule de apă neutru în soluție. În același timp, datorită reacțiilor la electrozi, straturile duble sunt din nou restaurate. Modificările care apar pe electrozii și în soluție sunt reflectate de următoarele ecuații:
3/2 O2g + H3O2 + 2e = 2OH-;
a căror sumă este o reacție de formare a apei:
H3g + 1 / 2O2g = H3Og,
Astfel, aceeași reacție pentru formarea apei din elemente poate fi efectuată în două moduri diferite. Care dintre aceste metode este mai avantajoasă din punctul de vedere al transformării energiei reacției chimice în muncă? În prima metodă de ardere a hidrogenului într-un calorimetru cu bombă (V = const) la 298 K scădere a energiei interne este egal cu numărul de căldura extrasă -du = 284,5 kJ / mol, iar munca este zero.
În al doilea caz, o parte din această schimbare a energiei interne (DG) poate fi transformată în muncă electrică. Dacă reacția din celula galvanică este reversibilă, atunci pierderea însoțitoare a energiei Gibbs se duce complet la producerea de lucrări electrice.
În cazul în cauză, ΔGo = -237,2 kJ / mol și, prin urmare, numai ~ 47 kJ / mol trece în căldură. Acest exemplu arată că, în general, energia eliberată la arderea combustibililor naturali este mai profitabilă pentru a se converti direct la combustibilii electrici, deoarece eficiența mașinilor termice și a centralelor termice este mică. Elementul de hidrogen-oxigen descris este un exemplu de așa-numitele celule de combustie.
Lucrarea de creare a unor astfel de elemente a fost recent dezvoltată pe scară largă în legătură cu noile sarcini ale tehnologiei. În aceste elemente, combustibilul și oxidantul trebuie depozitate separat și alimentate la electrozi pe care se efectuează reacțiile electrochimice. În acest caz, elementul poate funcționa în mod continuu, dacă reactivii sunt alimentați la el și produsele de reacție sunt retrase, ceea ce este deosebit de convenabil atunci când se utilizează substanțe lichide și gazoase. În locul arderii cărbunelui, este posibil să se utilizeze reacția Cm + O2z = CO2 pentru a obține un curent electric.
Evident, în condiții reale, celulele galvanice funcționează ireversibil, astfel încât numai o parte din schimbarea energiei Gibbs a reacției care curge în celulă se transformă în muncă. Să repetăm faptul că celula galvanică poate funcționa cu condiția ca în ea să apară o reacție chimică spontană sau un alt proces spontan însoțit de o scădere a energiei Gibbs.
În cazul în care elementul galvanic aplicat este aplicat extern o diferență de potențial suficient de mare care depășește emf. etc cu. și având direcția opusă, va exista o descompunere a apei cu eliberarea de hidrogen și oxigen. Astfel, procesele de obținere a curentului electric în celulele electrochimice și electroliza sunt reciproc opuse.
O caracteristică a procesului electrochimic într-o celulă galvanică este o posibilitate importantă pentru teoria implementării sale în condiții foarte apropiate de reversibilitate. Acest lucru este realizat datorită metodei potențiometrice în care e. etc cu. din celula galvanică studiată este aproape complet compensată de un emf direcționat opus. a. sursă externă. O astfel de tehnică face posibilă măsurarea emf. în absența curentului în circuit, adică când elementul nu funcționează și emf. este maximă. Monitorizarea absenței curentului este efectuată de galvanometre (instrumente zero) cu o sensibilitate ridicată. Ele dau o deformare atunci când trec un curent de 10-8 - 10-9 A. Un astfel de curent slab în timpul trecerii prin electrolit, chiar și timp de mulți ani, nu a putut aloca nici o cantitate apreciabilă de materie.
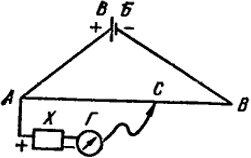
Fig. IX.2. Schema de măsurare a emf. metoda de compensare.
Schema schematică a măsurării e. etc cu. a celulei galvanice prin metoda de compensare este prezentată în Fig. IX.2. Curentul direct de la bateria auxiliară WB este alimentat la capetele cablului AB re-cord cu o secțiune transversală constantă. Prin urmare, căderea de tensiune de-a lungul rheochordului este proporțională cu lungimea segmentului corespunzător de pe linia AB. Cu ajutorul contactului mobil C se poate selecta o parte arbitrară a căderii de tensiune dintre punctele A și B. Din Fig. IX.2 arată că tensiunea preluată din orice parte a rheochordului, de exemplu, AC, este îndreptată spre e. etc cu. elementul X.
Prin mișcarea contactului C de-a lungul rheochordului, se găsește o poziție în care galvanometrul zero indică absența curentului în circuitul AChGS. Aceasta înseamnă că scăderea potențialului de pe BM pe segmentul AC compensează complet e. etc cu. elementul X.
Trimiteți-le prietenilor: