Forțele de atracție ale lui Coulomb care rezultă din interacțiunea ionilor încărcați sunt puternici și acționează în mod egal în toate direcțiile. Ca rezultat, aranjamentul ionilor este comandat în spațiu într-un anumit mod, formând o latură de cristal ionic. Substanțele cu Raman ionic în condiții normale sunt în stare cristalină, au puncte de topire și puncte de fierbere ridicate.
Metalele și aliajele lor cristalizează sub formă de laturi metalice. Nodurile din rețeaua metalică sunt ocupate de ioni metalici pozitivi. electronii valenta separați de atomii de metal și nodurile rămase în ionii de cristal cu zăbrele, mai mult sau mai puțin liber în spațiul dintre cationii și determină conductivitatea electrică a metalelor. Interacțiunile electrostatice apar între ioni și electroni liberi, care sunt cauza formării unei legături metalice.
Liantul metalic are similaritate cu ambele ionic (format datorită interacțiunii dintre particule încărcate: electroni și ioni) și covalente (electroni are loc de socializare, dar spre deosebire de legătură covalentă, unde electronii sunt localizate în jurul unor atomi, electronii din metale sunt partajate pentru toate cristal). Electronii liberi sunt denumiți uneori gaz de electroni.
Cationii din rețelele metalice nu au mișcare de translație, ci oscilează în jurul poziției zonelor de zăbrele. Amplitudinea acestor oscilații crește odată cu creșterea temperaturii și când temperatura de topire a metalului este atinsă, grâul se prăbușește. Punctul de topire al metalelor, ca regulă, crește odată cu creșterea numărului de electroni de valență în atomii lor.
Amestecurile a două sau mai multe metale individuale sunt numite aliaje. În aliaje, unele nemetale (carbon, sulf, siliciu) pot fi de asemenea prezente în cantități mici. O metodă obișnuită de obținere a aliajelor este de a-și încălzi componenții împreună până când amestecul este complet topit. Cu toate acestea, unele metale nu fuzioneaza intre ele in nici o relatie.
aliaje metalice pot fi clasificate după cum urmează: soluțiile solide interstițiale (Partea golurile interstițiale ale grilajului sunt ocupate de atomi ai altor elemente, cum ar fi atomii de carbon din fier-fier și oțel); soluții solide de substituție (o parte a atomilor substanței de bază este înlocuită cu atomi ai elementului de impurități - lipit de staniu - 64 părți de staniu și 36 de plumb); amestecuri de cristale individuale de metale; amestecurile de cristale ale compușilor intermetalici (metalele topite formează compuși chimici - în bronz există un compus Cu3 Sn)
Forțele Van der Waals sunt forțele interacțiunii intermoleculare (și interatomice) cu o energie de 10-20 kJ / mol. Acest termen a desemnat inițial toate aceste forțe, în știința modernă se aplică, de obicei, forțelor care apar în timpul polarizării moleculelor și formării dipolilor. Sunt deschis. D. van der Waals în 1869.
Van der Waals forțează gazele inerte interatomice cauza posibilității stărilor agregate de gaze inerte (gaz, lichid, corpuri solide).
Forțele van der Waals includ interacțiunile dintre dipoli (constante și induse). Numele se datorează faptului că aceste forțe sunt cauza corecției pentru presiunea internă în ecuația de stare a gazului real Van der Waals. Aceste interacțiuni, precum și legăturile de hidrogen determină formarea structurii spațiale a macromoleculelor biologice.
Forțele Van der Waals apar, de asemenea, între o particulă (particule macroscopice sau nanoparticule) și o moleculă și între două particule
15. Metoda de legături de valență. Ideea de hibridizare a orbitalilor atomici. Geometria moleculelor poliatomice: modelul Gillespie.
Metoda legătură de valență (MFR) este numit altfel teoria perechilor de electroni localizate, deoarece metoda se bazează pe presupunerea că legătura chimică dintre doi atomi se realizează prin una sau mai multe perechi de electroni, care sunt localizate predominant situate între acestea. Spre deosebire de OMI, care este pur și simplu o legătură chimică poate fi o dublă, și un multi-centru, în MBC este întotdeauna doi electroni în două centre și să fie sigur. Numărul de legături chimice elementare care pot forma un atom sau ion este egal cu valența sa. La fel ca în IMO, electronii de valență participă la formarea unei legături chimice. Funcția de undă care descrie starea electronilor ce formează legătura, se numește orbital localizată (LO).
Rețineți că electronii sunt descriși de către LR, în conformitate cu principiul de excluziune ar fi îndreptate în sens opus înapoi, adică în MVS toate rotirile sunt împerecheate, și toate moleculele ar trebui să fie diamagnetice. Prin urmare, MFR nu poate explica în principiu proprietățile magnetice ale moleculelor.
Cu toate acestea, principiul legăturilor localizate are o serie de avantaje importante, dintre care una este vizibilitatea sa extremă. MIF suficient de bine, de exemplu, prezice posibile atomii și geometria moleculei rezultate de valență. Ultima circumstanță este asociată cu așa-numita hibridizare a AO. A fost introdus în scopul de a explica faptul că doi electroni legăturile chimice în două centre formate în detrimentul SA în diferite state energetice au aceeași energie. Astfel, Be * (2s 1p 1 1), B * (2s 2p 2 1), C * (2s 2p 1 3) este format s - și p orbitali, respectiv, două, trei sau patru legături, și, prin urmare, una dintre ele ar trebui să fie mai puternice decât altele. Cu toate acestea, experiența arată că în BeH2. BCI3. CH4 toate conexiunile sunt echivalente. La unghiul de legătură BeH2 este de 180 °, la BCI3 - 120 °, în timp ce CH4 - 109 ° 28“.
Conform conceptului de hibridizare, legături chimice sunt formate mixte - orbitali hibride (GO), care este o combinație liniară atom AO (s - și p AOS Be, B, C), au aceeași energie și formează o anumită orientare în spațiu (simetrie ). Astfel, s- și p-orbitalul dau două sp-DO, situate la un unghi de 180 ° unul față de celălalt.
Hybrid orbital și geometria moleculelor
Modelul Gillespie se bazează pe presupunerea că cuplarea este efectuată de o pereche de electroni, iar structura geometrică a moleculelor / ionilor este determinată de numărul total de perechi de electroni care înconjoară atomul central. Sunt îndeplinite următoarele reguli:
· Perechile electronice, divizate și neparticipate, sunt situate în jurul atomului central astfel încât repulsia lor este minimă, adică la distanța cea mai îndepărtată una de cealaltă
· Perechea de electroni care nu este împărțită are un volum mai mare decât cel divizat
· Volumul ocupat de perechea de electroni care leagă este mai mic decât electronegativitatea atomului asociat centrului
· Două perechi de electroni cu o legătură dublă ocupă un volum mai mare decât o pereche de legături simple
Dezavantaje ale modelului Gillespie
· Inaplicabilitate la majoritatea compușilor d-, s-elementelor
· Inaplicabilitate la compuși cu o fracție semnificativă a ionicității legăturii
· Imposibilitatea de a prezice geometria moleculelor / ionilor cu o pereche de electroni inerți neparticipați
16. Metodă de orbitale moleculare. Concepte de bază. Două centrale orbitale moleculare cu două electroni. Diagrame energetice ale moleculelor diatomice homonucleare formate din elemente din perioadele 1 și 2. Proprietăți magnetice. Corelații între ordinea legăturii și energia ionizării. Diagrame energetice ale celor mai simple molecule heteronucleare (CO, HF, LiH, H20).
Metoda MOD, presupunem că în molecula ca un atom, se poate construi un set de niveluri de energie discrete permise și a valurilor funcții corespunzătoare lor (orbitali moleculare) care descriu comportamentul unui electron într-o moleculă. La fiecare nivel de energie, nu pot fi localizați mai mult de doi electroni. Pentru a construi funcțiile MO, se utilizează adesea orbitale atomice (AO), care descriu fiecare MI yi ca o combinație liniară de AO (MO LCAO).
Alegerea acestei reprezentări MO este destul de ușor de înțeles din punct de vedere fizic: în apropierea fiecărui nucleu dintr-o moleculă, comportamentul unui electron trebuie să fie similar cu comportamentul său la un atom și descris de atomul AO corespunzător. În acest caz, soluția aproximativă (deoarece pentru molecule ecuația Schrödinger poate fi rezolvată numai aproximativ!), Cel puțin în aceste regiuni va fi suficient de corect. În regiunea dintre nuclee, MO va fi descrisă printr-o suprapunere de AO. Problema găsirii funcțiilor de undă a MO în acest caz reduce la găsirea coeficienților. În plus, pentru fiecare MO, este necesar să se determine energia corespunzătoare.
17. Molecule de hidrogen și metode de descriere a acesteia. Metoda legăturilor de valență și metoda orbitalilor moleculari. Aproximarea LCAO. Suprapunerea orbitalilor atomici, a legăturilor sigma și pi, ordinea (multiplicitatea) conexiunii. Conectarea chimică în particulele H2. H2 - și H2 + din poziția metodelor MO și VS.
18. Legarea chimică în moleculele diatomice homonucleare ale elementelor celei de a doua perioade din poziția metodelor MO și BC. Schemele MO pentru moleculele de la începutul și sfârșitul celei de-a doua perioade. Modificarea ordinii legăturii, a energiei de legare și a lungimii legăturii în tranziția de la Li2 la Ne2. Caracteristicile moleculelor B2 și O2. Rezistența legăturii în molecula N2
19. Molecule diatomice heteronucleare ale elementelor din a doua perioadă. Schemele MO pentru HF, CO, CN, OF. Metoda BC și hibridizarea orbitalilor. Starea de valență a unui atom. Tipuri de hibridizare și structura spațială a moleculelor de către Gillespie.
20. Legătura covalentă în moleculele poliatomice. Interacțiunea donator-acceptor. Comunicare localizată și delocalizată. Conexiuni tri-centrate. Directivitatea și saturația legăturii chimice chimice. Teoria repulsiei perechilor de electroni ale cochiliei de valență și a structurii spațiale a moleculelor
Interacțiunea donator-acceptor - transferul de sarcină între molecule donor și acceptor fără formarea unei legături chimice între ele (mecanism de schimb); sau transferul unei perechi de electroni neparticipați de la donator la acceptor, conducând la formarea unei legături (mecanism donor-acceptor).
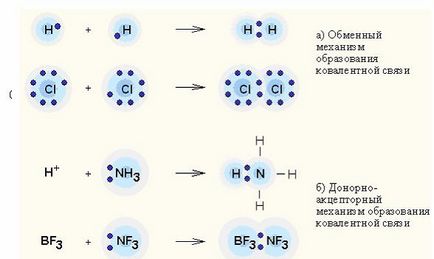
Legarea covalentă este cea mai generală formă de legare chimică, care rezultă din socializarea unei perechi de electroni printr-un mecanism de schimb. Când fiecare dintre atomii interacțiunii livrează un electron sau un mecanism donor-acceptor. dacă perechea de electroni este transferată la utilizarea obișnuită a unui atom (donor) la un alt atom (acceptor).
Comunicarea delocalizată este o legătură, a cărei pereche electronică este dispersată între mai multe (mai mult de 2) nuclee de atomi (asemănarea unei legături metalice).
Legătura covalentă poate fi localizată și delocalizată. Localizat este o legătură a cărei electroni sunt de fapt împărțiți între cele două nuclee ale atomilor care sunt legați. Dacă electronii legăturii sunt împărțiți de mai mult de două nuclee, atunci vorbește despre o conexiune delocalizată.
Legătura delocalizată este o legătură covalentă, a cărei orbită moleculară acoperă mai mult de doi atomi.
În majoritatea cazurilor, obligațiunile delocalizate sunt legăturile π. Acestea sunt caracteristice sistemelor conjugate. În aceste sisteme se realizează o formă specială de influență reciprocă a conjugării atomilor.
Conjugare (meso, din mesos greacă -. Mean) - această aliniere legăturilor și tarifelor în molecula reală (particule), în comparație cu un ideal, dar nici o structură existentă.
Participarea la conjugare delocalizat p orbitali poate să aparțină la două sau tt legături și mai mult sau π conexiune și un atom cu p orbital. În concordanță cu aceasta, π, π-conjugarea și # 961 ;, π-conjugare. Sistemul de interfață poate fi deschis sau închis și conține nu numai atomi de carbon, ci și heteroatomi.
Legătura cu trei centri cu două electroni este una dintre posibilele legături cu deficit de electroni. Caracterizat prin faptul că perechea de electroni de valență localizate în spațiul imediat trei atomi (de aici termenul „deficienți electron“ - „normal“ caz este de două centru legătura doi electroni). Descrierea generală a mecanismului de legături de electroni este dat în termenii teoriei orbitalilor moleculare (model Orbitali „nonbonding“).
Cea mai mare contribuție la dezvoltarea legăturilor cu două electroni teorie trohtsentrovyh sa realizat în studiul borohidrurilor și compuși organoboron în care legarea astfel este pus în aplicare foarte des (de exemplu, diboran).
Sunt posibile și alte legături cu deficiență de electroni, cu un raport diferit de electroni de valență la atomii legați. O astfel de legare este adesea realizată în compuși organometalici.
Teoria repulsiei perechilor de electroni ai orbitalilor de valență (OEVVO) este una din abordările din chimie necesare explicării și predicției geometriei moleculelor. Conform acestei teorii, molecula va lua întotdeauna o formă în care repulsia perechilor de electroni externi este minimă (principiul energiei minime).
Proprietățile caracteristice ale legăturii covalente - directivitatea, saturația, polaritatea, polarizabilitatea - determină proprietățile chimice și fizice ale compușilor.
Direcția legăturii se datorează structurii moleculare a substanței și formei geometrice a moleculei. Unghiurile dintre două legături se numesc legături de valență.
Saturația este capacitatea atomilor de a forma un număr limitat de legături covalente. Numărul de legături formate de un atom este limitat de numărul orbaliilor atomici externi.
Polaritatea conexiunii datorită distribuției inegale a densității de electroni, datorită diferenței de atomi electronegative. Pe această bază legături covalente subdivizat în nepolar și polar (nepolare - molecula diatomica este format din aceiași atomi (H2 Cl2 N2) și norii de electroni din fiecare atom sunt distribuite simetric în raport cu acești atomi .. Polar - molecula diatomica este format din atomi de diferite elemente chimice, și totalul electron nor se îndreaptă către unul dintre atomii, formând astfel o distribuție asimetrică a sarcinilor electrice în moleculă, generând momentul de dipol al moleculei).
Polarizabilitatea legăturii se exprimă prin deplasarea electronilor de legare sub influența unui câmp electric extern, incluzând o altă particulă de reacție. Polarizabilitatea este determinată de mobilitatea electronilor. Polaritatea și polarizabilitatea legăturilor covalente determină reactivitatea moleculelor în raport cu reactivii polari.
21. Legarea chimică și tipurile de cristale. Tipuri de laturi cristaline. Bazele teoriei bandelor. Conectarea în metale, semiconductori și dielectrice. Defecte ale rețelei de cristal. Soluții solide. Legarea ionică. Interacțiunea ionilor în rețeaua de cristal. Energia reticulului cristalin ionic, efectul dimensiunilor și încărcărilor de ioni
Teoria benzii, descrierea mișcării electronilor în cristale, este baza teoriei moderne a metalelor, a semiconductorilor și a dielectricilor.
Mărimea decalajului de bandă este o valoare cheie și determină proprietățile electrice și optice ale materialului.
Conductorii sunt materiale din care zona de conductivitate și zona de suprapunere a valenței formează o zonă - banda de conducție (astfel electronul se poate deplasa liber între ele).
Dielectricile sunt materiale din care zona nu se suprapune. Pentru a transfera un electron din banda de valență în banda de conducție, este necesară o energie considerabilă, astfel încât aproape nici un curent nu este produs de dielectrici.
Semiconductorii sunt materiale din care zonele nu se suprapun. Pentru a transfera un electron din banda de valență în banda de conducție, este necesară o energie mai mică decât pentru un dielectric, astfel încât semiconductoarele pure trec curentul slab.
Moleculare - moleculele sunt localizate la nodurile rețelei moleculare, această latură este inerentă într-un compus cu o legătură covalentă. aici nu sunt metale, (excepții pentru H, Si), toți compușii organici ai H2SO4-HCI
Atomic - în noduri sunt atomi diamant, grafit - nu se dizolvă în apa de refractar. în general nu este solubil
· Ionic - în noduri există ioni pozitivi, negativi, care sunt conectați unul cu altul prin atracția electrică a sării. baze, baze. Rezistență, punct de topire ridicat. nu volatile. multe sunt solubile în apă
· Metal - în noduri se află atomi de metal, căldură conductivă
Articole similare
Trimiteți-le prietenilor: