Compoziția acizilor carboxilici organici ca funcțională este o grupare carboxil
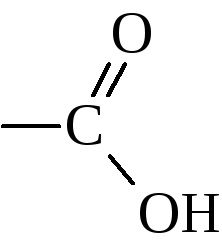
În funcție de numărul acestor grupuri, se disting unu, doi, trei, ... multi-bazici acizi. În funcție de tipul de radical atașat la carboxil ele sunt de obicei împărțite în alifatice (saturate și nesaturate), aliciclic, aromatic, etc.
5.1. Acizi carboxilici alifatici
5.1.1 Acizi saturați monobazici
Seria omoloagă a acestor acizi începe cu acid formic
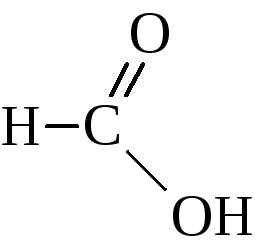
Izomerismul acizilor acestei serii este determinat de structura radicalului hidrocarbonat din grupul carboxilic și începe cu al patrulea membru al seriei. Denumirile triviale ale acizilor carboxilici au fost încorporate foarte ferm și sunt utilizate pe scară largă împreună cu denumirile nomenclaturii IUPAC. Numele acizilor din această nomenclatură sunt derivate din denumirea hidrocarburii corespunzătoare cu adăugarea acidului sufixic. Uneori acești acizi sunt numiți derivați ai acidului acetic.
- Metode bazate pe oxidare:
a) oxidarea alcoolilor primari (vezi subiectul "Compuși hidroxi");
b) oxidarea aldehidelor (vezi subiectul "Compuși carbonilici");
c) oxidarea hidrocarburilor terminale de oxigenul aerului pe catalizator. În oxidarea sintehinei (vezi subiectul "alcani"), această metodă dă un amestec de acizi cu lungimi diferite ale lanțurilor și este utilizat în industrie pentru producerea de detergenți.
- Hidroliza nitrililor. care sunt obținute prin acțiunea cianurii de potasiu pe haloalchii
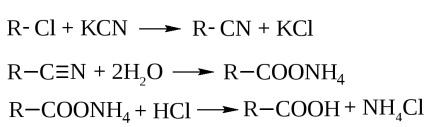
- Hidroliza trihaloalcanilor gemeni
- Sinteza prin compuși organomagnezi
- Oxosinteza - o metodă industrială de producere a acizilor carboxilici. Este acțiunea de monoxid de carbon la olefine (II) și vapori de apă la 300 ... 400 ° C, în prezența unui catalizator (de exemplu, Ni (CO) 4)
Acidele formice, acetic și propionic sunt lichide incolore ușor mobile, cu un miros acut caracteristic. Apa este amestecată în toate privințele. Acizii C4-C9 sunt lichide uleioase. Solubilitatea lor în apă scade puternic cu creșterea greutății moleculare. Acidele C10 și mai mari sunt substanțe cristaline solide, insolubile în apă.
Temperaturile de fierbere cresc cu creșterea greutății moleculare. Comparativ cu alcoolii având același număr de atomi de carbon, acizii se fierb mai sus. De exemplu, alcoolul etilic se fierbe la 78,3 ° C și acidul acetic la 118,5 ° C Acest lucru se datorează asocierii mai mari a moleculelor de acid și formării unor asociați mai solizi. Măsurătorile fizice indică în principal dimerizarea datorată legăturilor de hidrogen.
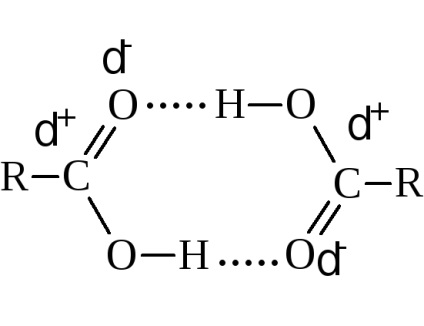
Acizii cu un număr par de atomi de carbon se topesc la o temperatură mai ridicată decât acizii cu un număr impar.
- Acizii carbonici sunt acizi protonici. În timpul disocierii, eliberează un proton
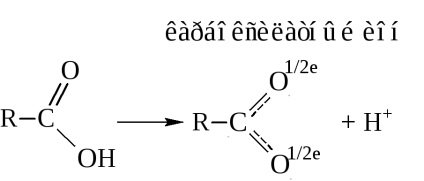
Proprietățile acide sunt explicate prin redistribuirea densității electronice în grupul carboxil față de oxigen.
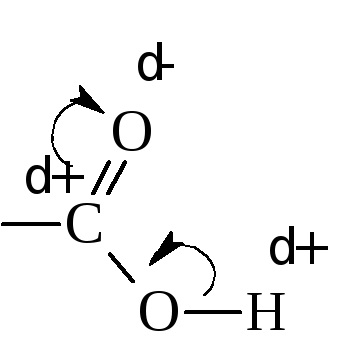
Drept rezultat, legătura O-H este slăbită și relativ ușor de rupt. Valoarea constantei de disociere depinde de valoarea încărcăturii fracționare pozitivă a carbonului carboxilic. Cu cât este mai mare, cu atât acidul este mai puternic. Gradul de disociere sau, cu alte cuvinte, puterea acizilor depinde și de mărimea și natura radicalului. legat de o grupare carboxil. Radicalii alchilici prin efectul de inducție crește densitatea de electroni în carboxil (sarcina pozitivă mai mică la carbonul carboxi), reducând astfel rezistența acidă.
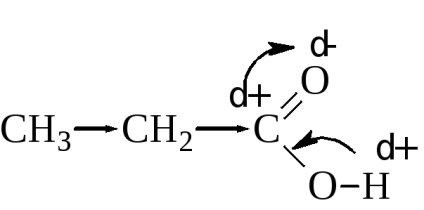
Cu o creștere a radicalului alchil, constantele de disociere ale acizilor carboxilici scad într-o oarecare măsură. Astfel, constanta de disociere a acidului formic H-COOH 2,17 · 10-4. acetil CH3-COOH 1,76 · 10-5 și capron CH3-CH2-CH2-CH2-CH2-COOH 1,31 · 10-5.
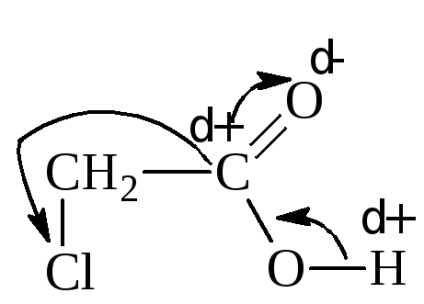
Introducerea unui grup electrofil, de absorbție a electronilor în radical, în schimb, mărește puterea acidului. De exemplu, constanta de disociere a acidului cloracetic este de 1,40 · 10-3.
- Ca toți acizii, acizii carboxilici sunt capabili să formeze săruri cu metale, oxizi și hidroxizi
Piroliza sărurilor de calciu produce aldehide și cetone, piroliza sodiului în prezența hidrocarburilor NaOH.
- Când acizii halogenurilor de fosfor sau halogenura de tionil acționează asupra acizilor, se formează halogenuri acide
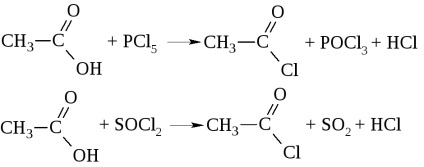
Halogenurile acide sunt denumite prin acid și halogen (clorura acidului acetic), precum și prin acilul radicalilor acide
În halogenurile acide, halogenura este extrem de mobilă și intră cu ușurință în reacția de schimb. Motivul mobilității halogenului este o încărcătură pozitivă mare asupra carbonului (δ +), care este conectat direct cu doi atomi de electroni care îndepărtează electronii - oxigen și halogen.
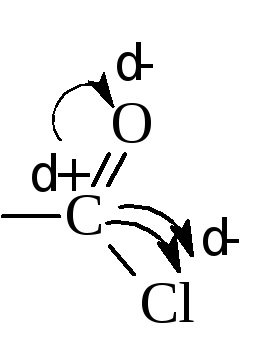
Acest carbon este ușor atacat de reactivi nucleofili.
În reacțiile de halogenuri cu compuși conținând metale sau un atom de hidrogen activ, atomii de metal sau de hidrogen sunt înlocuiți cu acil. Reacția se numește acilare. De exemplu, în cazul acidului acetic, aceasta este acetilarea.
Acilarea produce un număr de derivați acide. săruri, anhidride, esteri, amide, nitrili etc. De exemplu:
a) hidroliza clorurii acide sau acetilarea apei
b) alcooliza clorurii acide sau acetilarea alcoolilor
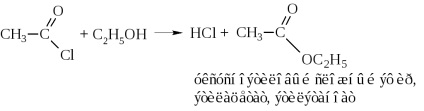
c) amonoliza clorurii acide sau acetilarea amoniacului
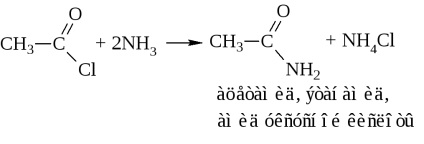
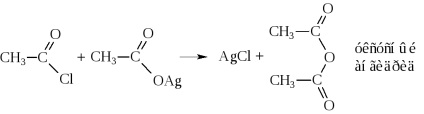
- Ca urmare a eliminării apei din două molecule de acid, se formează și anhidridele acide
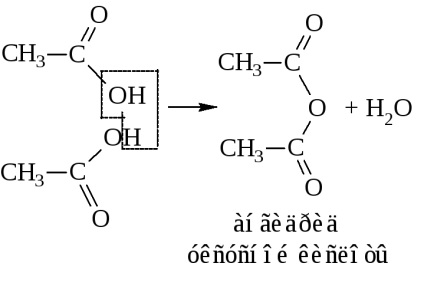
sau anhidridă a acidului etanic
Astfel, anhidridele se obțin numai în condiții foarte stringente: fie în prezența agenților puternici de deshidratare (P2O5), fie în prezența catalizatorilor (Al2O3) la temperaturi ridicate. Acestea sunt de obicei sintetizate prin acțiunea halogenurilor acide asupra sărurilor acide
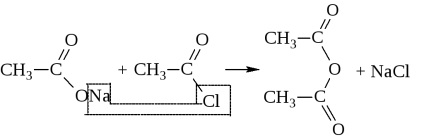
Anhidrida poate forma doi acizi diferiți.
Anhidridele de acizi sunt substanțe foarte active:
cu apă dau acizii corespunzători
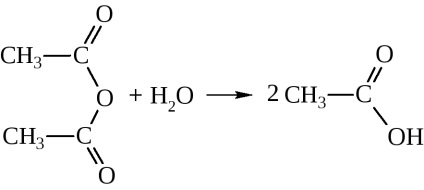
cu alcooli și amoniac formează amestecuri de acizi cu esteri și, respectiv, amide.
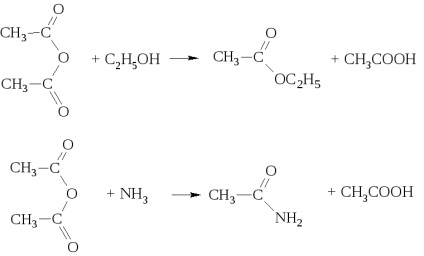
Anhidridele acide sunt agenți de acilare buni. Cu toate acestea, jumătate din molecula de anhidridă nu acilizează, dar este eliberată ca acid.
- amide ale acizilor. Acestea se obțin, de obicei, prin halogenuri acide și anhidride acide (vezi mai sus). În industrie, amidele sunt sintetizate prin acțiunea amoniacului pe acizi
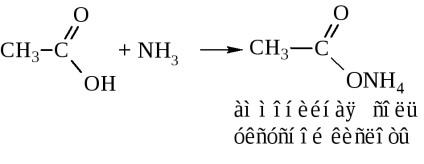
În distilarea uscată, sarea de amoniu eliberează apă pentru a forma o amidă
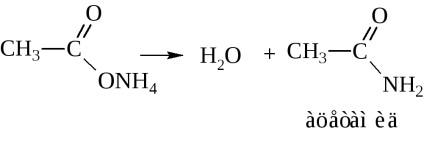
Acetamida prin nomenclatura IUPAC va fi numită etanamidă.
Atunci când aminele sunt acilate, se obțin alchil- și dialchilamide cu semnificație industrială.
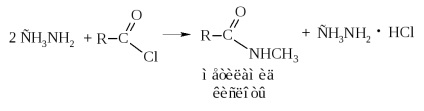
- Esterii pot fi obținuți prin interacțiunea directă a acidului cu alcoolul, adică reacția de esterificare a acizilor cu alcooli în prezența unui catalizator acid
Această reacție are chimisti interesați de mult timp. În 1862, Berthelot a stabilit că reacția de echilibru reversibil apare când reacționează aproximativ 2/3 din substanțele inițiale. La sfârșitul secolului XIX NA și NB Menshutkin a constatat că viteza reacției de esterificare depinde de structura de acid și alcool. S-a constatat că rata de esterificare scade odată cu creșterea numărului și volumului cu atomul de radicali α-carbon în raport cu carboxil. Acest fapt este în mod evident explicat prin screening-ul atomului de carbon al carboxilului cu radicali substituenți.
Cu ajutorul atomilor marcați (izotopul de oxigen O 18), s-a arătat că apa în timpul esterificării se formează datorită acidului hidroxilic și a alcoolului hidrogen
Numele esterilor conform nomenclaturii triviale sunt construite în conformitate cu următoarea schemă: numele radicalului alcoolic plus numele radicalului acid în care -il-ul final se înlocuiește cu -at. Conform nomenclaturii IUPAC: numele radicalului alcoolic plus numele acidului, în care noul sfârșit se înlocuiește cu -at.
Așa cum s-a arătat mai sus, esterii pot fi de asemenea preparați prin reacția alcoolilor cu anhidride și halogenuri acide.
În reacția cu alcoolii, esterii pot să facă schimb de radicali cu ei. Această reacție se numește transesterificare.
Deși apare o schimbare semnificativă a densității electronului până la oxigen în gruparea carboxil, atomul de carbon al carboxilului nu posedă atât o încărcătură pozitivă ca carbonul carbonilic în cetone și aldehide. Aceasta se datorează neutralizării parțiale a nesaturației electronice a carbonului prin deplasarea electronilor din hidroxil
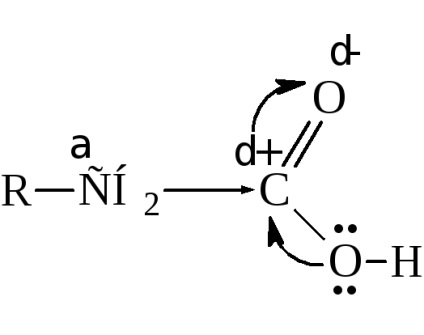
Și totuși, carboxilul afectează radicalul hidrocarbonat atașat la acesta, trăgând singură densitatea electronică și sporind activitatea atomilor de hidrogen, în special pentru a-carbon.
Clorurarea și bromurarea directă a acizilor carboxilici are loc în lumina introducerii de halogeni în poziția α.
Același mod obișnuit sintezaα galogenzameschonnyh-acizi este o metoda Gell-Folgand-Zelinsky. care constă în acțiunea acidului carboxilic cu clor molecular sau brom, în prezența fosforului
O altă metodă de sinteză care conduce la acizi substituiți cu halogenuri este hidroclorurarea acizilor carboxilici nesaturați a, p
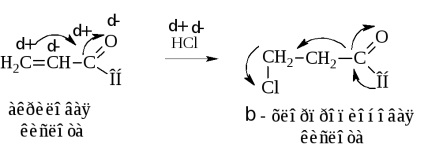
Adăugarea de HCI are loc în contradicție cu regula lui Markovnikov, datorită schimbării densității electronice de-a lungul sistemului de conjugare a moleculei la oxigen și în funcție de încărcăturile atomilor.
Acțiunea acizilor hidrohalici asupra acizilor hidroxi conduce, de asemenea, la rezultatul dorit
Înlocuirea α-hidrogen cu halogen crește în mod semnificativ rezistența acidului. Halogen retrage puternic perechea de electroni de la α-carbon, expunând încărcătura sa pozitivă. Aceasta, la rândul său, atrage electronii grupării hidroxil prin intermediul carbonului carboxilului. Astfel, prin efectul de inducție, protonul hidroxilic este activat. O imagine similară, deși mai puțin pronunțată, este de asemenea observată atunci când halogenul este îndepărtat din carboxil.
Atunci când hidrogenul este înlocuit în radicalul acid cu I, Br, CI, F și crește numărul de atomi de halogen, constantele de rezistență și de disociere ale acizilor (K) cresc consecutiv.
Acizii halogeni datorită activității ridicate au găsit o aplicare largă.
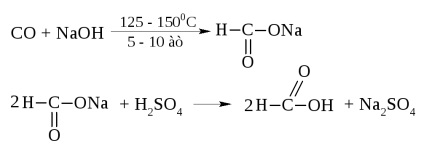
Acidul formic este un lichid cu t = 100,8 ° C și un miros ascuțit. Contactul cu pielea provoacă arsuri.
În industrie, este obținut din monoxid de carbon și sodă caustică
Acidul formic ocupă un loc special într-un număr de acizi. Împreună cu carboxil, poate fi izolată o grupă aldehidică.
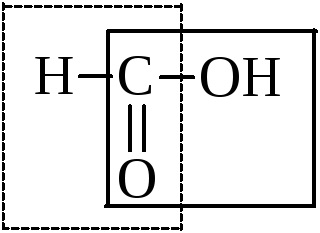
Prin urmare, având toate proprietățile de acizi, aceasta intră în reacția de oxidare: o oglindă de argint, cu un lichid de tăiere, adică în reacții tipice de aldehidă.
Acidul formic este utilizat pentru dezinfecție în medicină și industrie, în vopsirea țesăturilor, într-un număr de sinteze.
Acidul acetic anhidru la o temperatură de +16,6 ° C îngheață și este, prin urmare, numit gheață. punctul de fierbere. = 118,5 ° C
Obțineți-o prin hidratarea acetilenei, oxidarea alcoolului etilic și a hidrocarburilor saturate, fermentarea acidului acetic cu substanțe zaharoase și alte metode.
Din punct de vedere chimic, este un acid carboxilic obișnuit.
Folosit ca un solvent excelent în prelucrarea pieilor, vopsea, produse alimentare, chimice și alte industrii. Și se consumă în cantități mari.
Acizi grași mai mari
Cele mai cunoscute sunt C15H31COOH palmitic și acid stearic C17H35COOH. Acești acizi au molecule cu lanț normal de atomi de carbon. Ele sunt obținute prin saponificarea grăsimilor și oxidarea catalitică a parafinelor.
Sărurile acestor acizi sunt săpunuri. Sărurile de sodiu și potasiu ale acestor acizi sunt foarte solubile în apă și bine spălate. Sărurile de magneziu, calciu, bariu etc. (sărurile de duritate) sunt slab solubile în apă. Prin urmare, în apa dură, săpunurile obișnuite devin insolubile și nu se "spală".
Pentru a face lumânările să utilizeze un amestec solid de acizi grași superioare - stearină.
Articole similare
Trimiteți-le prietenilor: